
【题目】(1)某种烷烃A在同温同压下蒸气的密度是H2的43倍, 则该烃的分子式 。
(2)某烷烃B含有16个共价键,则该烃的同分异构体有 种。
(3)某烷烃C的结构简式为CH3CH2CH(CH3)2,则该烃的一氯取代物有 种。
(4)某烃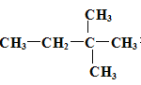 由另一种烃D通过加成反应而制得,则烃D的可能的是 (任写一种可能的结构简式)。
由另一种烃D通过加成反应而制得,则烃D的可能的是 (任写一种可能的结构简式)。
【答案】(1)C6H14 (2)3 (3)4
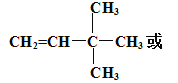
(4)
【解析】
试题分析:(1)某种烷烃A在同温同压下蒸气的密度是H2的43倍,则该烃的相对分子质量是43×2=86,根据烷烃的通式CnH2n+2可知14n+2=86,解得n=6,所以则该烃的分子式为C6H14。
(2)根据烷烃的通式CnH2n+2可知烷烃分子中共价键个数是2n+2+n-1=3n+1。如果某烷烃B含有16个共价键,则3n+1=16,即n=5,因此该烃是戊烷,有正戊烷、异戊烷和新戊烷三种同分异构体。
(3)某烷烃C的结构简式为CH3CH2CH(CH3)2,分子中含有4类氢原子,则该烃的一氯取代物有4种。
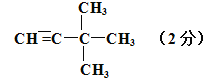
(4)烯烃或炔烃均可以与氢气加成得到烷烃,因此根据烷烃的结构简式可知烃D的可能的是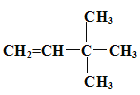 或
或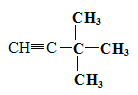 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质:

(1)实验室制备乙炔的化学方程式是_______________________________;
(2)实验过程中,为减缓生成乙炔的速率,通常采取的措施是:___________________________________________________________;
(3)B中试剂是 ;
(4)若C中试剂是溴水,可以观察到的现象是_________________。
Ⅱ.利用上述装置还可以验证醋酸、苯酚、碳酸的酸性强弱。
(1)A中固体试剂是 (选填序号);
A.醋酸钠 B.碳酸氢钠 C.苯酚钠
(2)C中反应的化学方程式是____________________________________;
(3)有同学认为没有B装置,也可以验证酸性的强弱,你认为合理吗?
_____(填“合理”或“不合理”);若不合理,原因是:
______________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途。

(1)写出Se的基态原子的外围电子排布式 。
(2)酒石酸钛配合物广泛应用于药物合成。酒石酸(结构如下图所示)中羧基氧原子的轨道杂化类型分别是 ,1 mol酒石酸中π键的数目是 。
(3)TiCl4熔点是—25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于 晶体;
NO3-离子的空间构型为 。
(4)主族元素A和钛同周期,具有相同的最外层电子数,元素B原子的p能级所含电子总数与s能级所含电子总数相等,且其形成的氢化物分子之间存在氢键。元素A、元素B和钛三者形成的晶体的晶胞如图所示,写出该晶体的化学式 (用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
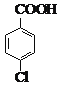
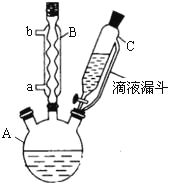
【题目】(14 分)对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应、装置图如下:
![]()
![]()
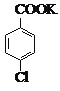 +MnO2
+MnO2 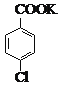
![]()
常温条件下的有关数据如下表所示:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 颜色 | 水溶性 | |
对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 194.5 | 具有盐的通性,属于可溶性盐 | ||||
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g。
请回答下列问题:
(1)装置B的名称是 。
(2)量取6.00mL对氯甲苯应选用的仪器是 。(填选仪器序号)
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是 。对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是 。
(4)第一次过滤的目的是 ,滤液中加入稀硫酸酸化,可观察到的实验现象是 。
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是 。
(6)本实验的产率是 (填标号)。A.60% B.70% C.80% D.90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气和氨气在常温下混合即可发生反应。某兴趣小组同学为探究纯净、干燥的氯气与氨气的反应,设计了如下装置:
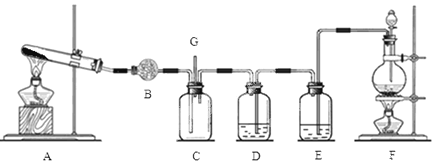
(1)装置F中发生反应的离子方程式是 ;
(2)装置B中盛放的是 ,其作用是 ;装置E中盛放的试剂是 ,其作用是 ;
(3)装置A中发生反应的化学方程式为: ;
(4)若有10.7gNH4Cl,最多可制取标准状况下的氨气的体积是 L;
(5)装置C中有白烟产生,试写出该反应的化学方程式
(6)G处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有 的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为1/3Fe2O3(s)+CO(g) ![]() 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
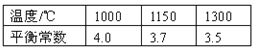
请回答下列问题:
(1)该反应的平衡常数表达式K= ,由于随着温度升高,平衡常数减小,所以正反应是 热反应(填“吸”或“放”);
(2)欲提高反应中CO的平衡转化率,可采取的措施是 ;
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.加入合适的催化剂
E.增大容器的容积
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,反应经过5min后达到平衡。求该时间范围内反应的平均反应速率:v (CO2)= 、CO的平衡转化率= 。(要书写解题过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】
X、Y、Z、R为前四周期原子序数依次增大的元素。X的单质与氢气可化合生成气体G.,其水溶液pH>7;Y的原子中最外层电子数是内层电子数的3倍;Z的单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。
请回答下列问题:
(1)Z元素在周期表中的位置________________;其单质的晶体类型是________________;X和Y元素的第一电离能较小的是___________(填元素名称);
(2)在Y、 Z的简单氢化物中,Y的氢化物更易溶于乙醇,其原因是_____________;G在一定条件下可与CO2反应生成一种最常见的氮肥M,M中所含元素原子的杂化方式为_____________;
(3) R单质与Z单质化合的产物J中,R离子的核外电子排布式是_____________;己知J与足量强碱性的NaC1O溶液在一定条件下反应,生成一种具有强氧化性的R的含氧酸根,该反应的离子方程式为_____________;
(4) G分子的立体构型为_______;R可形成化合物R(CO)5,该化合物中所含化学键的类型为_______;
(5) X与硼元素形成的化合物BX,其晶胞结构如图所示,该晶胞中含有的X原子数目为_____________;若最近的X、B原子之间的距离为anm,NA代表阿伏加德罗常数,则该晶体的密度为_____________g/cm
3(列式表示,不必化简)。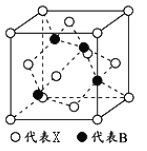
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种蓝色的晶体,它的结构特征是Fe2+和Fe3+分别占据立方体互不相邻的顶点,立方体的每个棱上均有一个CN-。
(1)根据晶体结构的特点,推出这种蓝色晶体的化学式(用简单整数表示)_____________。
(2)此化学式带何种电荷________,如用Rn+或Rn-与其结合成电中性粒子,此粒子的化学式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑨ | |||||||
5 | ⑩ |
(1)元素⑥的名称为 ;⑨的最高价含氧酸的化学式为 。
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为 。
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为 。(用离子符号表示)
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式 。
(5)用电子式表示③和⑨组成的化合物的形成过程 。
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质。写出该反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com