
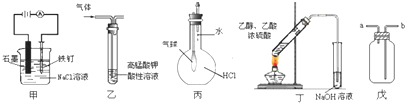
| A. | ①⑤ | B. | ②③ | C. | ③⑤ | D. | ④⑤ |
分析 ①金属做电解池的阳极时,更易被腐蚀;
②高锰酸钾具有氧化性,可以将乙烯以及乙炔氧化为二氧化碳;
③氯化氢极易溶于水,根据大气压强原理来分析;
④乙酸乙酯可以用饱和碳酸钠来吸收;
⑤装置可以收集气体,当集气瓶来用,但是要注意导管的连接情况.
解答 解:①在装置中,金属Fe做电解池的阳极,电极本身失电子,更易生锈,故①错误;
②高锰酸钾具有氧化性,可以将乙烯以及乙炔氧化为二氧化碳,不能用装置乙可除去乙烯中混有的乙炔,故②错误;
③氯化氢极易溶于水,挤压胶头滴管,则集气瓶中压强减小,所以气球鼓起来,可以使用该装置验证HCl气体在水中的溶解性,故③正确;
④乙酸乙酯可以用饱和碳酸钠来吸收,不能用氢氧化钠,乙酸乙酯在氢氧化钠中水解,故④错误;
⑤装置可以收集气体,当集气瓶来用,导管长进短出时,可以收集密度大于空气的气体,如:CO2、Cl2、HCl、NO2等气体,如果导管短进长出,则可以收集密度小于空气的气体,如氢气,故⑤正确.
故选B.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol C7H16中含有23 mol共价键 | |
| B. | 标准状况下1.12 L NH3中含有0.5 mol e- | |
| C. | 常温常压下0.37g 2H35Cl中含有0.2mol中子 | |
| D. | 40 g NaOH 溶于1 L水,所得溶液中c(Na+)=1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
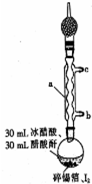 四碘化锡是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:
四碘化锡是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
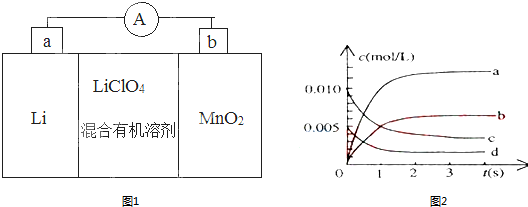
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | a | |||||||
| 2 | b | c | d | |||||
| 3 | e | f | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 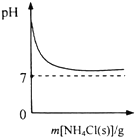 表示向NH3•H2O溶液中逐步加入NH4Cl固体后,溶液pH的变化 | |
| B. | 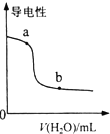 表示向NH3•H2O溶液中加水时溶液的导电性变化,则NH3•H2O溶液的pH:b>a | |
| C. | 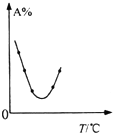 表示等量A在容积相同的恒容密闭容器中,不同温度下分别发生反应:2A(g)?B(g)+C(g),相同时间后测得A含量的曲线,则该反应的△H<0 | |
| D. | 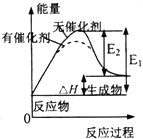 表示催化剂能改变化学反应的焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在pH为6.37及10.25时,溶液中c(CO32-)=c(HCO3-)=c(H2CO3) | |
| B. | 反应HCO3-+H2O═H2CO3+OH- 的平衡常数为10-10.25 | |
| C. | 0.1mol•L-1NaHC2O4溶液中c(HC2O4-)+c(C2O42-)+c(H2C2O4)=0.1mol•L-1 | |
| D. | 往Na2CO3溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4═HC2O4-+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
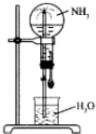 四个等体积的圆底烧瓶分别充满①NH3②HCl③NO2④NO2和O2的混合物进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度大小关系为( )
四个等体积的圆底烧瓶分别充满①NH3②HCl③NO2④NO2和O2的混合物进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度大小关系为( )| A. | ①>②>③>④ | B. | ①=②=③=④ | C. | ①=②=③>④ | D. | ①=②>③>④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com