
| A. | a+b=2c | B. | a+b>2c | C. | a+b<c | D. | a+b<2c |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用石蕊试液能一次区分开CH3CH2OH、CH3COOH、 和CCl4四种物质 和CCl4四种物质 | |
| B. | 变质的植物油有难闻的特殊气味,是由于植物油发生了酯化反应 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 能与NaOH溶液发生反应,分子式为C2H4O2的有机化合物一定是羧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若生成4.48 L HF,则转移0.8 mol电子 | |
| B. | 还原剂与氧化剂的物质的量之比为1:4 | |
| C. | 氧气是氧化产物 | |
| D. | 除O2外,其余反应物和生成物中均只有极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 与金属钠完全反应时,两者物质的量之比为1:3 | |
| B. | 与氢氧化钠完全反应时,两者物质的量之比为1:1 | |
| C. | 与碳酸氢钠溶液反应时,两者物质的量之比为1:2 | |
| D. | 在一定条件下,既能与羧酸反应,又能与醇反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
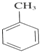 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$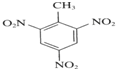 +3H2O;
+3H2O; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 向反应后的溶液加入乙醇,溶液没有发生变化 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com