
| A. | 反应物能量总和大于生成物能量总和 | |
| B. | 反应中生成1mol水蒸气放出285.8 kJ的热量 | |
| C. | 2H2O(1)=2H2(g)+O2(g)△H=+571.6 kJ.mol-1 | |
| D. | 当反应中有2 mol H-H键断裂,该反应放出571.6 kJ的热量 |
分析 A.由焓变可知,为放热反应;
B.气态水比液态水的能量高;
C.互为逆反应时,焓变的数值相同、符号相反;
D.当反应中有2 mol H-H键断裂,可知2molH2参加反应,物质的量与热量成正比.
解答 解:A.由焓变可知,为放热反应,则反应物能量总和大于生成物能量总和,故A正确;
B.反应物相同,而气态水比液态水的能量高,则反应中生成1mol水蒸气放出热量小于285.8 kJ,故B错误;
C.由2H2(g)+O2(g)═2H2O(1)△H=-571.6kJ/mol可知,其逆反应为2H2O(1)=2H2(g)+O2(g)△H=+571.6 kJ/mol,故C正确;
D.当反应中有2 mol H-H键断裂,可知2molH2参加反应,物质的量与热量成正比,由热化学方程式可知,该反应放出571.6 kJ的热量,故D正确;
故选B.
点评 本题考查热化学方程式,为高频考点,把握反应中能量变化、状态与能量的关系、物质的量与热量的关系为解答的关键,侧重分析与应用能力的考查,注意物质的量与热量成正比,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molFe与足量氯气充分反应时转移的电子数为2NA | |
| B. | 18 g水中所含的电子数为10NA | |
| C. | 0.3 mol•L-1Na2SO4溶液中含0.6NA个Na+ | |
| D. | 11.2 L氮气中含NA个氮原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精、汽车在桌面上着火时,立即用水扑灭 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应立即转移到容量瓶中定容,以减小误差 | |
| D. | 用分液漏斗分液时,下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
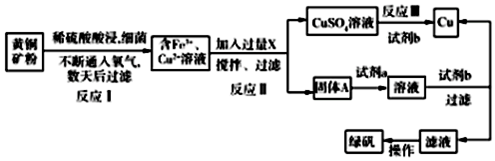
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
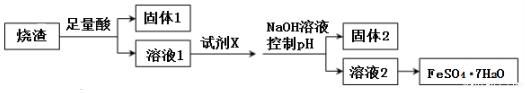
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种溶液pH的大小顺序是③>②>① | |
| B. | 若将3种溶液稀释相同倍数,pH变化最大的是② | |
| C. | 若分别加入25 mL 0.1 mol/L盐酸后,pH最大的是① | |
| D. | 3种溶液中,由水产生的c(H+)大小顺序是①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

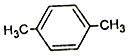 D.
D.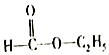
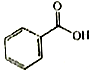 F.
F. 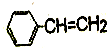 G.
G.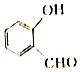
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为河虾中含有砷元素,所以不能食用 | |
| B. | “两者同食”发生的反应中维生素C作氧化剂 | |
| C. | 五价砷在维生素C作用下发生了还原反应 | |
| D. | 已知砒霜的主要成分是氧化砷,可以推测所含的砷元素化合价为+5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com