
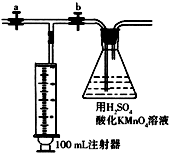
 已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量.
已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量.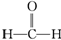 .
.分析 (1)甲醛分子中两个碳氢键,一个碳氧双键,据此书写结构式;
(2)在银镜反应中,甲醛中碳为0价,可以被氧化成+4价,银从+1价降为0价,根据电子得失守恒可计算得到的银的物质的量;
(3)高锰酸钾溶液具有强氧化性,能够氧化橡胶管;
(4)注射器压送气体速度过快,空气中甲醛没有完全被吸收;
(5)当反应完毕,溶液中高锰酸钾溶液的紫红色会消失;
(6)先计算出总的高锰酸钾的物质的量,然后利用滴定数据计算出草酸消耗的高锰酸钾的物质的量,再计算出甲醛消耗高锰酸钾的物质的量,最后计算出1m3空气中含有的甲醛的质量,根据居室中甲醛含量标准,判断出空气质量情况.
解答 解:(1)甲醛分子中两个碳氢键,一个碳氧双键,结构式为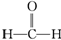 ,
,
故答案为: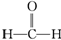 ;
;
(2)在银镜反应中,甲醛中碳为0价,可以被氧化成+4价,银从+1价降为0价,根据电子得失守恒可知,1mol甲醛最多可以制4mol银,
故答案为:4;
(3)由于高锰酸钾溶液具有强氧化性,不能使用碱式滴定管,应该选用酸式滴定管盛装,
故答案为:酸式滴定管;
(4)如果注射器压送气体速度过快,空气中的甲醛没有完全被高锰酸钾溶液吸收,导致测定结果偏低,
故答案为:偏低;
(5)反应结束时,溶液的紫红色会褪去,所以滴定终点判断方法为:最后一滴草酸标准溶液滴下,溶液紫红色褪去且半分钟内不恢复,即为滴定终点,
故答案为:以高锰酸钾为指示剂,最后一滴草酸标准溶液滴下,溶液紫红色褪去且半分钟内不恢复,即为滴定终点;
(6)5.00mL 1.00×10-3mol/L的高锰酸钾溶液中含有的高锰酸钾的物质的量为:0.005L×1.00×10-3mol/L=5×10-6mol,高锰酸钾消耗的草酸物质的量为:1.00×10-3mol/L×0.01238L=1.238×10-5mol,根据反应2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O,草酸消耗的高锰酸钾的物质的量为:$\frac{2}{5}$×1.238×10-5mol=4.952×10-6mol,甲醛中的高锰酸钾的物质的量为:5×10-6mol-4.952×10-6mol=4.8×10-8mol,根据反应4MnO4-+5HCHO+12H+→4Mn2++5CO2↑+11H2O,
500mL空气中含有的甲醛物质的量为:$\frac{5}{4}$×4.8×10-8mol=6×10-8mol,
1m3空气中含有的甲醛物质的量为:6×10-8mol×$\frac{10{\;}^{6}mL}{500mL}$=1.2×10-4mol,甲醛的质量为:1.2×10-4mol×30g/mol=3.6mg<0.08mg,所以该空气合格,
故答案为:3.6;是.
点评 本题考查了空气中甲醛含量测定,根据反应的化学方程式,计算室内空气中甲醛含量,并与标准进行对照,判断室内甲醛是否超过标准,本题难度中等.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下2.24LO2 | B. | 含NA个氢原子的H2 | ||
| C. | 44gCO2 | D. | 含3.01×1023个分子的CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
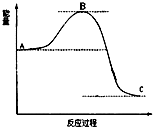 已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$ 2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$ 2SO3(g)反应过程的能量变化如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
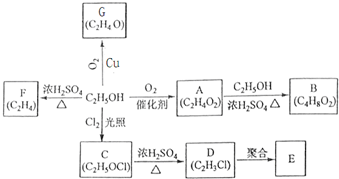 乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如图所示:回答下列问题:
乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如图所示:回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | A、B中的氢的质量分数必相等 | |
| B. | A、B的实验式必相同 | |
| C. | A、B一定是同系物 | |
| D. | A、B可以是烃,也可以是烃的含氧衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Fe3+、Br-、NO3- | B. | Fe2+、H+、NO3-、K+ | ||
| C. | Fe3+、Br-、NO3-、Cl- | D. | Fe2+、Br-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 30min时降低温度,40min时升高温度 | |
| B. | 前8min A的平均反应速率为0.17mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为吸热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com