
分析 同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键;结构对称,正负电荷的中心重合,则为非极性分子;结构不对称,正负电荷的中心不重合,则为极性分子;由离子键组成的化合物为离子化合物,据此分析.
解答 解:P4 只含有非极性键,属于非极性分子;
NH3只含极性键,为三角锥形结构,结构不对称,正负电荷的中心不重合,为极性分子;
CH4只含极性键,为正四面体形分子,结构对称为非极性分子;
CO2 只含极性键,为直线形分子,结构对称为非极性分子;
O3只含有非极性键,结构不对称,属于极性分子;
H2S 只含极性键,结构不对称,正负电荷的中心不重合,为极性分子;
SO2只含极性键,结构不对称,正负电荷的中心不重合,为极性分子;
BF3只含极性键,为正三角形分子,结构对称为非极性分子;
H2O2含极性键和非极性键,结构不对称,正负电荷的中心不重合,为极性分子;
HF只含极性键,结构不对称,正负电荷的中心不重合,为极性分子.
(1)存在极性键的非极性分子是CO2、BF3、CH4,故答案为:CO2、BF3、CH4;
(2)存在非极性键的非极性分子是P4,故答案为:P4;
(3)存在非极性键的极性分子是O3、H2O2,故答案为:O3、H2O2.
点评 本题考查了键的极性和分子的极性、离子化合物的判断,题目综合性较强,侧重于基础知识的考查,题目难度不大,注意掌握分子极性的判断方法.


科目:高中化学 来源: 题型:推断题
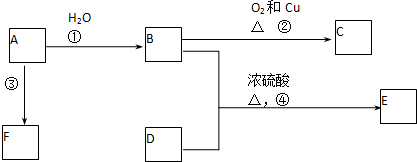

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
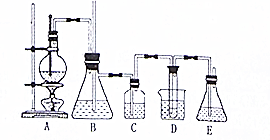 实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:
实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:| 常温下颜色状态 | 密度 | 熔点 | 沸点 | 溶解性 |
| 无色液体 | 2.18g/cm3 | 9.79℃ | 131.4℃ | 不溶于水、一溶于醇、醚、丙酮 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D四种短周期元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p 轨道中有3个未成对电子,其气态氢化物的水溶性在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4.请问答下列问题:
有A、B、C、D四种短周期元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p 轨道中有3个未成对电子,其气态氢化物的水溶性在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4.请问答下列问题: ,CB3分子的VSEPR模型为四面体形.
,CB3分子的VSEPR模型为四面体形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体使酚酞试液变红 | B. | 气体能使湿润的红色石蕊试纸变蓝 | ||
| C. | 气体与蘸有浓H2SO4的玻璃棒靠近 | D. | 气体与蘸有浓盐酸的玻璃棒靠近 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②>①>④>③ | B. | ①=②=③=④ | C. | ②=③>①=④ | D. | ②<①<③<④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.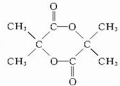 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com