
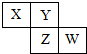
| A、Z元素的原子半径比Y元素的大 |
| B、若Y的最低化合价为-2,则W的最高正化合价为+6 |
| C、若Z的最高正化合价为+5,则X元素的化合物最多 |
| D、若HmZOn为强酸,则Y是活泼非金属元素 |


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
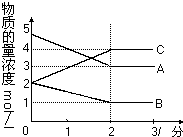 在密闭容器中,某反应在不同反应时间各物质的量的变化情况如右图所示(各物质均为气体).
在密闭容器中,某反应在不同反应时间各物质的量的变化情况如右图所示(各物质均为气体).查看答案和解析>>
科目:高中化学 来源: 题型:
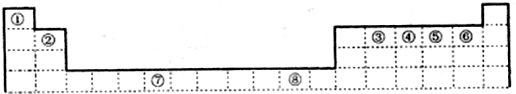
 如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )
如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )| A、X元素的原子有二个电子层,处于周期表的第14纵行 |
| B、X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 |
| C、Z的原子序数为31,单质常温下为液体 |
| D、气态氢化物水溶液的酸性X<Z<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
 室温下,在0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )
室温下,在0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )| A、a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-?Al(OH)3 |
| B、a-b段,溶液pH增大,Al3+浓度不变 |
| C、b-c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| D、d点时,Al(OH)3沉淀开始溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤的干馏、石油的分馏都是物理变化 |
| B、工业上常用澄清石灰水和氯气反应制漂白粉 |
| C、蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,都属于“盐析” |
| D、二氧化硅可以用于制造光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原溶液中至少存在3种离子 |
| B、原溶液中一定不存在的离子是:Cl-、CO32-、OH- |
| C、原溶液中可能存在的离子有:Cl-、Al3+和K+ |
| D、原溶液中一定存在的离子是:NH4+、Fe3+、SO42-和Cl-,且c(Cl-)≥0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com