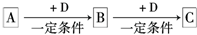Ⅰ.已知a、b、c、d、e为短周期主族元素.其中
①a和b属同周期元素,二者能形成多种气态化合物;
②a和c属同周期元素,二者能形成两种气态化合物;
③a和d属同主族元素,二者能形成两种常见化合物;
④e可分别和a、b、c、d形成具有相同电子数的共价化合物甲、乙、丙、丁.
请回答:
(1)a元素为______,甲的分子式为______,丁的电子式为______.
(2)由上述一种或几种元素形成的物质可与水发生氧化还原反应但不属于置换反应,写出一个符合要求的化学反应方程式:______.
Ⅱ.碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活.
已知①2CH
4(g)+3O
2(g)═2CO(g)+4H
2O(l);△H
1=-1214.6kJ/mol;
②CO
2 (g)═CO (g)+
O
2(g);△H
2=+283kJ/mol
则甲烷燃烧热的热化学方程式为______.
(2)将不同量的CO(g)和H
2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H
2O(g)?CO
2(g)+H
2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
| H2O |
CO |
CO2 |
CO |
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1中,以v(H
2)表示的平均反应速率为:______ mol/L?min.
②该反应的正反应为______(填“吸”或“放”)热反应;
③若要使实验3达到平衡状态时各物质的体积分数与实验2分别相等,则a、b应满足的关系是______(用含a、b表示).



 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案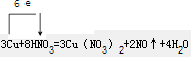

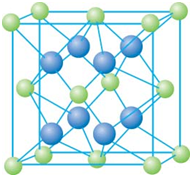 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:


 A~I分别表示中学化学中常见的一种物质,它们之间相互转化关系如图所示(部分反应物、生成物没有列出),且已知A、B、C、D、E、F六种物质中均含同一种元素,A、I是两种常见的金属单质.H在常温下是一种常见的非金属气态单质.
A~I分别表示中学化学中常见的一种物质,它们之间相互转化关系如图所示(部分反应物、生成物没有列出),且已知A、B、C、D、E、F六种物质中均含同一种元素,A、I是两种常见的金属单质.H在常温下是一种常见的非金属气态单质.