
室温下,等体积0.5mol/L的①KCl ②FeCl3 ③HF ④Na2CO3四种物质的水溶液中,所含阳离子数目由多到少的顺序是
A.④①②③ B.③①②④ C.①④③② D.④②①③
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。

①浓盐酸液滴附近会出现白烟。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括
Fe2+ + 2NH3·H2O → Fe(OH)2↓+ 2NH4+ 和 _________ 。(化学方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象与氢键有关的是
①H2O的熔、沸点比VIA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④NH3在水中的溶解度很大 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定:
A.①②③④⑤⑥ B. ①②③④⑤
C. ①②③④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素可以形成多种化合物。回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是____________。
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1。计算说明N2中的
键更稳定(填“p”或“σ”)。
(3)已知CN-与N2结构相似,推算HCN分子中σ键与p键数目之比为 ;
N2与O22+互为等电子体,O22+的电子式可表示为 。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一
种氮的氢化物。
①NH3分子的空间构型是_____________;N2H4分子结构式为_________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2 N2H4 (l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的p键有________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z为3种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y 2Z达到平衡时,若它们的物质的量满足n(X)+n(Y)=n(Z),则Y的转化率为
2Z达到平衡时,若它们的物质的量满足n(X)+n(Y)=n(Z),则Y的转化率为
A. ×100% B.
×100% B. ×100%
×100%
C. ×100% D.
×100% D. ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列混合溶液中,各离子浓度的大小顺序正确的是( )
A. 10 mL 0.1 mol ·L-1氨水与10 mL 0.1 mol ·L-1盐酸混合,
c(Cl-)>c(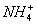 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B. 10 mL 0.1 mol ·L-1NH4Cl溶液与5 mL 0.2 mol ·L-1NaOH溶液混合,
c(Na+)=c(Cl-)>c(OH-)>c(H+)
C. 10 mL 0.1 mol ·L-1CH3COOH溶液与5 mL 0.2 mol ·L-1NaOH溶液混合,
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D. 10 mL 0.5 mol ·L-1CH3COONa溶液与6 mL 1 mol ·L-1盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)已知在448℃时,反应H2(g)+I2(g) 2HI(g)的平衡常数K1为49,则该温度下 反应
2HI(g)的平衡常数K1为49,则该温度下 反应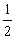 H2(g)+
H2(g)+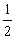 I2(g)
I2(g) HI(g)的平衡常数K2为__________。
HI(g)的平衡常数K2为__________。
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________________。
(2)该反应为__________反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是( )。
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D. c(CO2)=c(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知室温下,Ka(HF)=6.8×10-4mol·L-1,Ka(CH3COOH)=1.7×10-5 mol·L-1。关于物质的量浓度均为0.1mol/L的NaF和CH3COONa混合溶液,下列说法正确的是( )
A.c(OH-)>c(HF)>c(CH3COOH)>c(H+) B.c(OH-)>c(F-)>c(CH3COO-)>c(H+)
C.c(F-)+ c(CH3COO-)=2 c(Na+) D.c(HF)+c(CH3COOH)+ c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如
图6所示。下列说法不正确的是
A.离子半径的大小顺序为:r(W2—)>r(Q—)>r(Y2—)>r(Z3+)
B.元素W的最高价氧化物对应水化物的酸性比Q的强
C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com