
【题目】下列说法错误的是
A.氯乙烯与丙烯的共聚物高分子中可能存在“![]() ”的连接方式
”的连接方式
B.丙氨酸和苯丙氨酸脱去一分子水,最多可生成4种二肽
C.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
D.![]() 和
和![]() 均可以通过缩聚反应制取
均可以通过缩聚反应制取
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中的硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l) △H<0。一定温度下,在容积为2L的恒容密闭容器中1molSO2和nmolCO发生反应,5min后达到平衡,生成2amolCO2。下列说法正确的是
2CO2(g)+S(l) △H<0。一定温度下,在容积为2L的恒容密闭容器中1molSO2和nmolCO发生反应,5min后达到平衡,生成2amolCO2。下列说法正确的是
A. 反应前2min的平均速率v(SO2)=0.1amol/(L.min)
B. 当混合气体的物质的量不再改变时,反应达到平衡状态
C. 平衡后保持其它条件不变,从容器中分离出部分硫,平衡向正反应方向移动
D. 平衡后保持其他条件不变,升高温度和加入催化剂,SO2的转化率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度,将2molCO与5 mol H2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。经过5min后,反应达到平衡,此时转移电子6mol。
CH3OH(g)。经过5min后,反应达到平衡,此时转移电子6mol。
(1)0~5min内,v(CH3OH)=____
(2)若保持体积不变,再充入2molCO和1.5molCH3OH,此时v(正)__v(逆)(填“>”“<”或“=”),平衡常数为____。
(3)在题干其他条件不变的情况下,再增加2molCO与5molH2,达到新平衡时,H2的体积分数与原平衡对比:____。
(4)已知CO与H2在一定条件下也能合成乙醇,0.5mol乙醇液体燃烧生成二氧化碳和水蒸气,放出的热量为617.1kJ/mol,又知H2O(l)═H2O(g);△H=+44.2kJ/mol,请写出乙醇燃烧热的热化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是
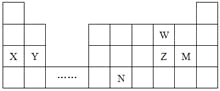
A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃、101 kPa 下,11.4 g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出 551.76 kJ 能量。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(g) ΔH=-551.76 kJ·mol-1
O2(g)=8CO2(g)+9H2O(g) ΔH=-551.76 kJ·mol-1
B.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5517.6 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5517.6 kJ·mol-1
C.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=5517.6 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=5517.6 kJ·mol-1
D.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-551.76 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-551.76 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.0.1molL-1CH3COOH溶液加水稀释,CH3COO-数目增多,c(OH-)增大
B.室温下,NaHSO3溶液的pH<7,说明![]() 的电离程度大于其水解程度
的电离程度大于其水解程度
C.酸碱质子理论认为,凡能给出质子(H+)的物质都是酸,凡能接受质子的物质都是碱。由该理论可知:NaHCO3、H2O、Al(OH)3均可称为酸碱两性物质
D.25℃时0.1molL-1的H2S水溶液中,加入一定量的NaOH溶液,当溶液中存在:c(Na+)=c(S2-)+c(HS-)+c(H2S)时,溶液的主要溶质为Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器中发生反应:A(g)+3B(g) ![]() 2C(g),下列有关说法正确的是
2C(g),下列有关说法正确的是
A.若加入催化剂,则反应的△H 增大
B.加压时,平衡向正反应方向移动,反应的平衡常数增大
C.若反应温度升高,则活化分子的百分数增大,反应速率增大
D.若低温时,该反应为正向自发进行,则△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂。以氯酸钠(NaC1O3)为原料 制备NaC1O2粗品的工艺流程如下图所示。

己知:①纯C1O2易分解爆炸,空气中C1O2的体积分数在10%以下比较安全。
②NaClO2高于60°C会分解。
(1)反应I的离子方程式为____;反应中需同时鼓入空气的主要目的是____ °
(2)“合成”过程中的氧化剂是______。
(3)蒸发时,需要减压的目的是_____。
(4)“冷却结晶”后获得NaClO,粗产品的操作是_____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用加热铵盐和碱的混合物的方法制取氨气。
(1)写出图中大试管中发生反应的化学方程式 ______________________________。
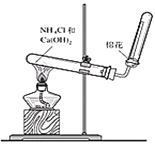
(2)收集氨气时,判断氨气是否收集满可采用的方法是_________________________。
(3)也可利用加热浓氨水的方法制取少量的氨气,此法利用了氨水的________性质。将收集满氨气的烧瓶组装成如图所示的装置。
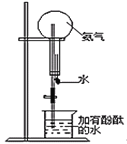
当挤压胶头滴管,使少量的水进入烧瓶,打开弹簧夹可以观察到的现象是:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com