
| A. | 该元素的电负性是同主族最大的 | |
| B. | 其轨道表示式为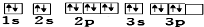 | |
| C. | 该元素的第一电离能是同周期元素中最大的 | |
| D. | 该元素可以形成2种常见的氧化物 |
分析 价电子构型为3s23p4的元素是16号元素S,属于氧族元素,
A.氧族元素中非金属性最强的为O元素;
B.3p能级上电子排布图违反洪特规则;
C.非金属性越强,第一电离能越大;
D.S能够形成二氧化硫和三氧化硫两种氧化物.
解答 解:价电子构型为3s23p4的元素是16号元素S,属于氧族元素,
A.该元素为S,非金属性S<O,则电负性S<O,故A错误;
B.当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同,所以3p能级上电子排布图违反洪特规则,故B错误;
C.S元素位于第三周期,该周期中非金属性最强的为Cl,则第一电离能增大的为Cl,故C错误;
D.硫元素存在二氧化硫和三氧化硫2种氧化物,故D正确;
故选D.
点评 本题考查了原子核外电子排布,题目难度不大,明确原子核外电子排布规律为解答关键,注意掌握电负性、第一电离能、构造原理等知识,试题培养了学生的分析能力及灵活应用能力.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:计算题
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度/ (mol•L-1) | 2 | 1 | 4 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
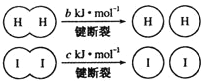
| A. | 向密闭容器中加入1 mol H2(g)和2mol I2(g),充分反应后放出的热量有可能等于a kJ | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 断开2 mol H-I键所需能量约为(c+b+a)kJ | |
| D. | 断开1 mol I-I键的同时形成2mol H-I键,说明反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙酸铜是合成优良催化剂、传感材料-纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料-纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: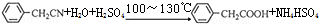 (苯乙腈)
(苯乙腈)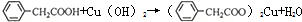
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
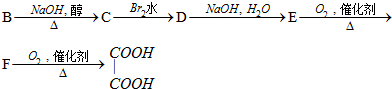
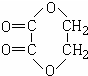
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
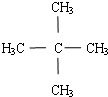 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
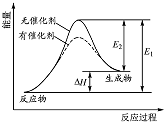
| A. | 该反应的反应物总能量高于生成物总能量 | |
| B. | 使用催化剂可以增大该反应的反应热 | |
| C. | 该化学反应的反应热为E1,且反应放热 | |
| D. | 化学反应在物质变化的同时,必然伴随能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制备氢氧化亚铁 | B. |  石油的分馏 | ||
| C. |  测定盐酸浓度 | D. |  配制稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10 mL 量筒量取 7.50 mL 稀盐酸 | |
| B. | 用托盘天平称取 25.20 g NaCl晶体 | |
| C. | 用广范 pH试纸测得某碱溶液的pH为12.7 | |
| D. | 用25 mL 碱式滴定管量取14.80 mL NaOH 溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com