
某课外活动小组同学用如图装置进行实验,试回答下列问题:
(1)若开始时开关K与a连接,则B极的电极反应为 。
(2)若开始时开关K与b连接,则B极的电极反应为 ,总反应的离子方程式为 。有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。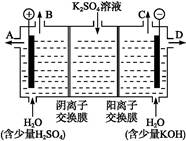
①该电解槽的阳极反应为 。
此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因 。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应为 。
科目:高中化学 来源: 题型:填空题
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni—Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是________(填字母序号)。
①以上反应是可逆反应 ②以上反应不是可逆反应 ③充电时化学能转变为电能 ④放电时化学能转变为电能
| A.①③ | B.②④ |
| C.①④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学能与电能之间的相互转化与人类的生活实际密切相关,在生产、生活中有重要的应用,同时也是学生形成化学学科素养的重要组成部分。
(1)熔融状态下,钠的单质和氯化亚铁能组成可充电电池,如图9-8工作原理示意图,反应原理为2Na+FeCl2 Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;
Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;
充电时,____________(写物质名称)电极接电源的负极;该电池的电解质为________。
(2)某同学用铜片、石墨作电极电解一定浓度的硫酸铜溶液,工作原理示意图如图所示,一段时间停止通电取出电极。若在电解后的溶液中加入0.98 g氢氧化铜粉末恰好完全溶解,经测定所得溶液与电解前完全相同。请回答下列问题:
①Y电极材料是________,发生________(填“氧化”或“还原”)反应。
②电解过程中X电极上发生的电极反应式是_______________________________________________________________________。
③如在电解后的溶液中加入足量的小苏打,充分反应后产生气体在标准状况下所占的体积是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙的实验装置如图所示,丙、丁分别是氯碱工业生产示意图和制备金属钛的示意图。
请回答下列问题:
(1)写出甲装置中碳棒表面的电极反应式:_______________________________。
(2)已知:5Cl2+I2+6H2O=10HCl+2HIO3。若将湿润的淀粉KI试纸置于乙装置中的碳棒附近,现象为________________________________;若乙装置中转移0.02 mol电子后停止实验,烧杯中溶液的体积为200 mL,则此时溶液的pH=________。(室温条件下,且不考虑电解产物的相互反应)
(3)工业上经常用到离子交换膜,离子交换膜有阳离子交换膜和阴离子交换膜两种,阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。当乙装置中的反应用于工业生产时,为了阻止两极产物之间的反应,通常用如丙图所示的装置,Na+的移动方向如图中标注,则H2的出口是________(填“C”、“D”、“E”或“F”);________(填“能”或“不能”)将阳离子交换膜换成阴离子交换膜。
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaO作电解质,利用丁装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极的电极反应式:___________________________________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)__________________________________________________________。
③电解过程中需定期更换阳极材料的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电解原理在化学工业中有广泛的应用。如图表示一个电解池, 装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为 ,在X极附近观察到的现象是 。电解液中向X极方向移动的离子是 。
②Y电极上的电极反应式为 ,
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是
②Y电极的电极反应式为 (说明:杂质发生的反应不必写出。)
③溶液中的c(Cu2+)与电解前相比 (填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
)如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
(1) 一段时间后,甲中溶液颜色 ,
写出甲中C的电极反应式 。
(2) 若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3) 现用丙装置给铜件镀银,电镀液是 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为 。
(4) 若将F电极更换为铁,其他装置都不变,则乙中发生总反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以氯化钾和硫酸亚铁原料生产硫酸钾和氧化铁红颜料,其主要流程如下:
已知: 溶液呈碱性,30℃以上溶液中
溶液呈碱性,30℃以上溶液中 大量分解。
大量分解。
(1)写出 溶液中的物料守恒___________________________________
溶液中的物料守恒___________________________________
(2)写出沉淀池I中反应的化学方程式_______________________,该反应必须控制的反应条件是___________________________。
(3)检验沉淀I中 沉淀是否完全的方法是__________________________________。
沉淀是否完全的方法是__________________________________。
(4)酸化的目的是___________________________。
(5)在沉淀池II中,为使 晶体分离出来用到过滤操作,过滤时用到的主要玻璃仪器是__________________________。
晶体分离出来用到过滤操作,过滤时用到的主要玻璃仪器是__________________________。
(6)N、P、K、S都是植物生长所需的重要元素。滤液A可做复合肥料,因为其中含有___________等元素。
(7)中国海洋大学应用化学研究所在乙醇燃料电池技术方面获得突破,组装出了自呼吸电池及主动式电堆。乙醇燃料电池的工作原理如图怕示。
①该电池工作时,c口通入的物质为___________。
②该电池负极的电极反应式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯碱工业中电解饱和食盐水的原理示意图如下图所示:
(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42->c(Ca2+)]。精致流程如下(淡盐水和溶液A来自电解池): 
①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,如下图所示,铁处于①、②、③三种不同的环境中。请回答:
(1)金属腐蚀主要分为 腐蚀和 腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是 (填序号)。
(3)②中正极的电极反应式为 ,
负极的电极反应式为 ,
③中负极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com