
| A. | ①②③④ | B. | ①③④⑤ | C. | ②④⑤ | D. | ②③④⑤ |
分析 ①加入Al能放出H2的溶液,为非氧化酸或强碱溶液;
②pH=13的溶液,显碱性;
③水电离出来的c(H+)=10-13 mol/L的溶液,为酸或碱溶液;
④AlCl3溶液中,离子之间相互促进水解;
⑤能使甲基橙呈黄色的溶液,显酸性、中性或碱性.
解答 解:①加入Al能放出H2的溶液,为非氧化酸或强碱溶液,碱溶液中不能存在NH4+、HCO3-,酸溶液中不能大量存在HCO3-,故选;
②pH=13的溶液,显碱性,该组离子之间不反应,可大量共存,故不选;
③水电离出来的c(H+)=10-13 mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在S2O32-,碱溶液中不能存在NH4+,故选;
④AlCl3溶液中,Al3+分别与HCO3-、HS-相互促进水解,不能大量共存,故选;
⑤能使甲基橙呈黄色的溶液,显酸性、中性或碱性,酸溶液中H+、SO32-、ClO-发生氧化还原反应,不能大量共存,故选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、水解反应的判断,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 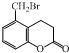 +3NaOH→ +3NaOH→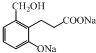 +NaBr+2H2O +NaBr+2H2O | |
| B. |  +Na2CO3→ +Na2CO3→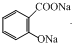 +CO2↑+H2O +CO2↑+H2O | |
| C. | n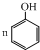 +n +n 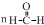 $→_{△}^{催化剂}$ $→_{△}^{催化剂}$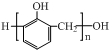 +(n-1)H2O +(n-1)H2O | |
| D. | C12H22O11(麦芽糖)$\stackrel{H+}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | ①能使溴的四氯化碳溶液褪色 ②比例模型如图 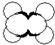 ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成 ②球棍模型如图 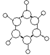 |
| C | ①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2 ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>O2>N2>H2O | D. | 金刚石>生铁>纯铁>钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2LH2中含有的氢原子一定为1mol | |
| B. | 16gCH4在标准状况下的体积约为22.4L | |
| C. | 71gCl2中含有的氯原子数约为6.02×1023 | |
| D. | 1L 0.5 mol/LBaCl2溶液中Cl-的物质的量浓度为0.5 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com