
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2=-58 kJ/mol
CH3OH(g)+H2O(g) △H2=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41 kJ/mol
CO(g)+H2O(g) △H3=+41 kJ/mol
回答下列问题:
(1)CO2的电子式是 。
(2)△H1= kJ/mol,①反应正向的熵变△S 0(填>、<或=)。
(3)在容积为2L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图,下列说法正确的是__________(填序号)
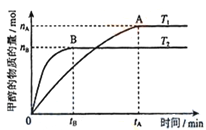
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tA mol/(L·min)
②当v(CH3OH) = v(H2O)时,说明反应达到平衡
③混合气体的平均相对分子质量A点大于B点
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入2L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;T1温度,反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数数值为__________。
CO2(g)+3H2(g)的平衡常数数值为__________。
【答案】(1)![]() ;
;
(2)-99;<
(3)③④
(4)3:4;6.75或27/4
【解析】
试题分析:(1)CO2的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)①CO(g)+2H2(g) ![]() CH3OH(g) △H1,②CO2(g)+3H2(g)
CH3OH(g) △H1,②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H2=-58 kJ/mol,③CO2(g)+H2(g)
CH3OH(g)+H2O(g) △H2=-58 kJ/mol,③CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H3=+41 kJ/mol,根据盖斯定律:反应②-反应③=反应①,故△H1=△H2-△H3=-99 kJ/mol,反应①中气体的物质的量减少,属于熵减小的反应,故答案为:-99;<;
CO(g)+H2O(g) △H3=+41 kJ/mol,根据盖斯定律:反应②-反应③=反应①,故△H1=△H2-△H3=-99 kJ/mol,反应①中气体的物质的量减少,属于熵减小的反应,故答案为:-99;<;
(3)①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=![]() =nA/2tA mol/(L·min),错误;②根据CO2+3H2
=nA/2tA mol/(L·min),错误;②根据CO2+3H2![]() CH3OH+H2O,如何时刻都存在v(CH3OH) = v(H2O)时,不能说明反应达到平衡,错误;③该反应属于气体的物质的量减少的反应,甲醇的物质的量越多,混合气体的物质的量越少,混合气体的平均相对分子质量越大,混合气体的平均相对分子质量A点大于B点,正确;④处于A点的反应体系从T1变到T2,平衡向逆反应方向移动,达到平衡时n(H2)与n(CH3OH)比值增大,正确;故选③④;
CH3OH+H2O,如何时刻都存在v(CH3OH) = v(H2O)时,不能说明反应达到平衡,错误;③该反应属于气体的物质的量减少的反应,甲醇的物质的量越多,混合气体的物质的量越少,混合气体的平均相对分子质量越大,混合气体的平均相对分子质量A点大于B点,正确;④处于A点的反应体系从T1变到T2,平衡向逆反应方向移动,达到平衡时n(H2)与n(CH3OH)比值增大,正确;故选③④;
(4)温度T2先达到平衡,则温度T2>T1,又温度高时平衡状态CH3OH的物质的量少,则说明升高温度,可逆反应CO2+3H2![]() CH3OH+H2O向逆反应方向移动,故正反应为放热反应;
CH3OH+H2O向逆反应方向移动,故正反应为放热反应;
CO2转化率为50%,转化的二氧化碳为1mol,则:
CO2 (g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始(mol):2 6 0 0
变化(mol):1 3 1 1
平衡(mol):1 3 1 1
相同条件下,气体的压强之比等于物质的量之比,则容器内的压强与起始压强之比为=![]() =
=![]() ,平衡常数=
,平衡常数=![]() =
=![]() =
=![]() ,CH3OH(g)+H2O(g)
,CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数与CO2+3H2
CO2(g)+3H2(g)的平衡常数与CO2+3H2![]() CH3OH+H2O的平衡常数互为倒数,因此CH3OH(g)+H2O(g)
CH3OH+H2O的平衡常数互为倒数,因此CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数=
CO2(g)+3H2(g)的平衡常数=![]() ,故答案为:
,故答案为:![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
(1)该反应的平衡常数表达式为K=________。
(2)该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的平均反应速率为________。
(3)该反应达到平衡后,加入Fe粉,平衡________移动;保持恒温恒容通入CO,平衡向________移动。(填“向左”、“向右”或“不”)
(4)表明该反应已达平衡状态的是______________
A.单位时间内生成nmolCO同时生成nmolCO2 B.恒容时混合气体的压强不变
C.混合气体的总质量不变 D.CO2的体积分数不变 E.Fe的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列热化学反应方程式:
(1)1molN2(g)与适量H2(g)起反应生成NH3(g),放出92.2kJ热量:______________。
(2)1molN2(g)与适量O2(g)起反应生成NO(g),吸收68kJ热量:_______________。
(3)1molCu(s)能与一定量的O2(g)起反应生成CuO(s),放出157kJ热量:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br-
B.SO42-
C.H2SO3
D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
A.25 ℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)=c(OH-)=c(![]() )=c(Cl-)
)=c(Cl-)
B.25 ℃时,向10 mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液: c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.0.1 mol·L-1的CH3COONa溶液与0.1 mol·L-1的CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
D.浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(![]() )的大小顺序为③>②>①
)的大小顺序为③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应4CO+2NO2![]() N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A.v(CO)=1.5mol·L-1·min-1B.v(NO2)=0.8mol·L-1·min-1
C.v(N2)=0.3mol·L-1·min-1D.v(CO2)=1.1mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法不正确的是( )
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨,s)=C(金刚石,s) ΔH= +1.9kJ/mol,可知石墨比金刚石稳定
D.已知H2(g)+Cl2(g)=2HCl(g) ΔH1= -184.6kJ/mol,则反应HCl(g)=![]() H2(g)+
H2(g)+![]() Cl2(g)的ΔH= -92.3kJ/mol
Cl2(g)的ΔH= -92.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
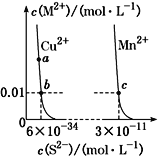
A. 在含有CuS和MnS固体的溶液中c(Cu2+)∶c(Mn2+)=1∶2×10-23
B. 向CuSO4溶液中加入MnS发生反应:
Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)
CuS(s)+Mn2+(aq)
C. a点对应的Ksp等于b点对应的Ksp
D. 该温度下,Ksp(CuS)小于Ksp(MnS)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
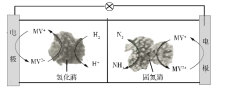
A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com