
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。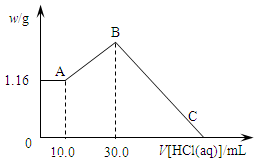
(1)A点的沉淀物的化学式为 。
(2)写出A点至B点发生反应的离子方程式: 。
(3)原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为 mL。
(1)Mg(OH)2 (2)AlO2-+H++H2O=Al(OH)3↓ (3)5.20 130.0
解析试题分析:(1)向所得浊液中,逐滴加入1.00mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:①0~10ml,随盐酸的体积增加,生成沉淀的质量不变,说明氢氧化钠过量,加入的盐酸与氢氧化铝先反应,方程式为NaOH+HCl=NaCl+H2O。因此A点沉淀是Mg(OH)2,其质量是1.16g,物质的量n= =
=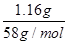 =0.02mol。则根据原子守恒可知原混合物中氯化镁的物质的量=0.02mol。
=0.02mol。则根据原子守恒可知原混合物中氯化镁的物质的量=0.02mol。
(2)NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O。NaOH过量,溶液是NaCl、NaAlO2和NaOH的混合液,则A~B阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓。
(3)A~B阶段消耗盐酸的物质的量=(0.03L-0.01L)×1.0mol/L=0.02mol,则根据方程式NaAlO2+HCl+H2O=Al(OH)3↓+NaCl可知生成氢氧化铝的物质的量=0.02mol。所以根据原子守恒可知原混合物中氯化铝的物质的量是0.02mol。B点沉淀达到最大值,此时的沉淀是氢氧化镁和氢氧化铝的混合物。而溶液则恰好是氯化钠溶液。根据氯离子守恒可知氯化钠的物质的量=0.03L×1.00mol/L+0.02mol×2+0.02mol×3=0.13mol。所以根据钠离子守恒可知,氢氧化钠的物质的量也是0.13mol,因此氢氧化钠的质量m=n· M=40g/mol×0.13mol=5.2g。B~C阶段加入的盐酸开始溶解氢氧化铝和氢氧化镁,此时反应的方程式为Mg(OH)2+2HCl=MgCl2+2H2O;Al(OH)3+3HCl=AlCl3+3H2O。根据氢氧化镁和氢氧化铝均是0.02mol可知,该阶段消耗盐酸的物质的量是0.02mol×2+0.02mol×3=0.10mol,其体积是0.10mol÷1mol/L=0.1L=100ml,所以C点(此时沉淀恰好完全溶解)HCl溶液的体积为30ml+100ml=130ml。
考点:考查镁、铝合金与氢氧化钠溶液以及元素反应的有关计算与判断、图像分析与应用


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:填空题
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下: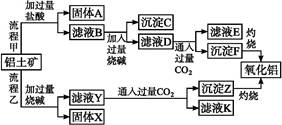
已知2Na2SiO3+2NaAlO2+2H2O Na2Al2Si2O8↓+4NaOH,请回答下列问题:
Na2Al2Si2O8↓+4NaOH,请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后Al2O3发生反应的离子方程式为 。
(3)固体X的主要成分是 ,过滤时使用的玻璃棒,其作用是 。
(4)滤液B中溶质的主要成分是 (填化学式);滤液E、K中溶质的主要成分是 (填化学式),写出该溶液的一种用途 。
(5)在流程中,选用CO2作酸化剂,为什么不选用盐酸? 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁是人类生产和生活中必不可少的重要金属。
(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为___________。
计算铁元素的近似相对质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%、a2%……是指各同位素的____________________。
(2)铁原子中有______种能量不同的电子,铁原子次外层的电子云有_____种不同的伸展方向。
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为________________________________。
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于_________极,电解质溶液是____________________。
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:
___Fe(NO3)3 + ___NaOH + ___Cl2 →___Na2FeO4 + ___NaNO3 + ___NaCl + ___H2O
高铁酸钠除了能消毒杀菌外,还能吸附水中的悬浮物,其原因是______________________。
(6)0.03mol的铁加到过量的HNO3中,加热,铁完全溶解,若生成NO、NO2的混和气体共1.12L(标准状况)。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。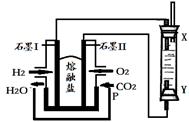
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
纯碱、烧碱等是重要的化工原料。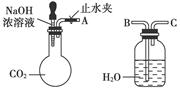
(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 ,若其他操作不变,将A与C连接,可观察到的现象是 。
(2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是
| A.NaOH和Na2CO3; | |
| B.; | |
| C.; | D.。 |
| 实验操作 | 实验现象 | 结论 |
| (1)取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | | |
| (2) | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
据新华社报道,发展改革委员会于2007年4月发出“遏制铝冶炼投资反弹”的紧急通知。原因是铝冶炼属高耗能产业,而且某些铝冶炼企业以污染环境为代价,得不偿失。
如图是传统的工业生产金属铝的基本流程图,阅读上述新闻信息,结合铝生产的流程图解答下列问题: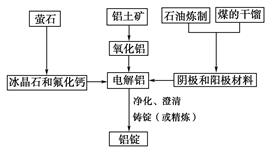
请回答:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品____________(填物质名称)作电解铝的阴极和阳极材料。
(2)氧化铝熔点高达2050 ℃,工业上为了降低能量消耗,在金属铝的冶炼中采取的措施是__________________________。
(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是:__________________________________________(用化学方程式表示)。
(4)工业上制取金属镁时是电解MgCl2,电解反应方程式为_________________,镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物?原因是:
________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据下列转化关系以及现象回答: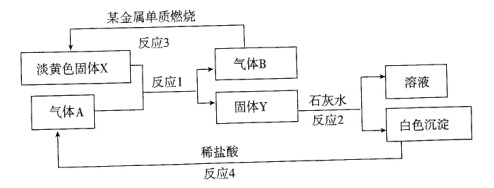
(1)固体X的名称是 ,Y的化学式是 。
(2)写出反应l的化学方程式 。
(3)写出反应2的化学方程式 。
(4)若15.6g X和足量水反应,转移 mol e-。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一粒绿
豆大小的金属钠,观察到的现象正确的是________________。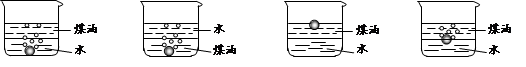
A B C D
(2)金属钠失火时,应该用 灭火。
(3)过氧化钠可用作潜水艇的供养剂,主要化学反应方程式为 。
(4)实验室盛放氢氧化钠溶液的试剂瓶不用玻璃塞,是因为玻璃中含 (填化学式),刻蚀玻璃常用的试剂是氢氟酸,发生反应的化学方程式为 。
(5)制取水泥和陶瓷的共同原料是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”。
①M的原子结构示意图为______。
②以M、Al为电极,KOH溶液为电解质溶液,则负极的电极反应式为______。
(2)淬火是将金属工件加热到某温度,随即浸入淬冷介质中快速冷却的金属热处理工艺。
①使用水进行淬火,若生成磁性氧化铁,该反应的化学方程式为____________
②验证铁用水淬火后的固体产物是否存在+3价的铁,可选用的试剂为_______ (填序号)
| A.H2O2溶液 | B.铜粉 | C.稀硫酸 | D.KMnO4溶液 |
 4Fe(OH)3+8OH—+3O2
4Fe(OH)3+8OH—+3O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com