
| A. | 0.2 mol | B. | 0.3 mol | C. | 0.6 mol | D. | 1.4 mol |
分析 重铬酸钾(K2Cr2O7)中的铬的化合价为:+6价,所以0.1mol K2Cr2O7得到电子的物质的量为(6-3)×2×0.1mol=0.6mol,1mol的Cl-氧化为氯气,失去1mol的电子,根据得失电子守恒分析解答.
解答 解:重铬酸钾(K2Cr2O7)中的铬的化合价为:+6价,所以0.1mol K2Cr2O7得到电子的物质的量为(6-3)×2×0.1mol=0.6mol,1mol的Cl-氧化为氯气,失去1mol的电子,则0.1mol K2Cr2O7可氧化Cl-的物质的量为0.6 mol,
故选C.
点评 本题考查氧化还原反应的计算,明确氧化还原反应中转移电子相等是解本题关键,知道常见元素化合价,题目难度不大.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LHNO3溶液 | B. | 0.1mol/LH2SO4溶液 | ||
| C. | 0.1mol/LBa(OH)2溶液 | D. | 0.1mol/LNaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液和盐酸 | B. | NaHCO3溶液和Ca(OH)2溶液 | ||
| C. | NaOH溶液和浓AlCl3溶液 | D. | 稀硫酸和碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
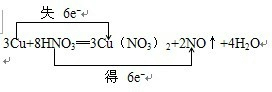 ,该反应中氧化剂是硝酸,氧化产物与还原产物的物质的量之比为3:2.
,该反应中氧化剂是硝酸,氧化产物与还原产物的物质的量之比为3:2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | KNO3的溶解度大 | 用重结晶法除去KNO3中混有的NaCl |
| B | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
| C | 用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
| D | Ca(OH)2能制成澄清石灰水 | 可配制2.0mol•L-1的Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
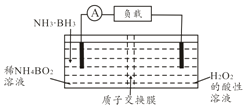 直接氨硼烷(NH3•BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3•BH3+3H2O2═NH4BO2+4H2O.下列说法正确的是( )
直接氨硼烷(NH3•BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3•BH3+3H2O2═NH4BO2+4H2O.下列说法正确的是( )| A. | 左侧电极发生还原反应 | |
| B. | 电池工作时,H+通过质子交换膜向负极移动 | |
| C. | 正极的电极反应式为2H++2e-=H2↑ | |
| D. | 消耗3.1g氨硼烷,理论上转移0.6mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com