
| A. | A+B═C+D | B. | 2A+B═2C+D | C. | A+B═2C+D | D. | 2A+B═C+2D |
分析 根据质量守恒定律计算出消耗A、B,生成C、D的质量,然后根据n=$\frac{m}{M}$计算出参加反应的A、B、C、D的物质的量之比,从而可知该反应的化学方程式.
解答 解:根据质量守恒定律可计算出消耗A的质量为:25g-10g=15g,A有剩余,则5gB会完全反应,
反应后的混合物中含有21gC,则反应生成C的质量为:21g-10g=11g,
根据质量守恒定律可知生成D的质量为:15g+5g-11g=9g,
剩余反应过程中四种物质的物质的量关系为$\frac{15}{30}$:$\frac{5}{20}$:$\frac{11}{44}$:$\frac{9}{18}$=2:1:1:2,故该反应的化学方程式为:2A+B═C+2D,
故选D.
点评 本题考查了混合物反应的计算、化学方程式的计算,题目难度中等,正确判断反应中各反应物、生成物质量不会为解答关键,注意掌握质量守恒定律在化学计算中的应用,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与CO2反应 | D. | NaOH与HCl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾是氧化剂,Na2O2既是氧化剂,又是还原剂 | |
| B. | 反应的氧化产物只有氧气 | |
| C. | 当反应产生标准状况下2.24 L O2 时,反应转移的电子为0.1mol | |
| D. | 通常所说的酸化的高锰酸钾溶液是指滴加了浓盐酸的高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将质量分数为40%(密度为1.43g•cm-3)的NaOH溶液与等体积水混合,所得溶液中溶质的质量分数是20% | |
| B. | 要配制浓度为0.25mol•L-1的NaOH溶液480mL,应称量4.8gNaOH在250mL的烧杯中溶解,冷却,再转移到500mL容量瓶中,洗涤、转移、定容 | |
| C. | 配制一定物质的量浓度的溶液,定容时俯视刻度线导致所配浓度偏高 | |
| D. | 通入Cl2,除去Fe2(SO4)3溶液中的FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料电池的燃料都在负极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中$\frac{c({CH}_{3}C{OO}^{-})}{c({CH}_{3}COOH)}$的值增大到原来的100倍 | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++5OH-═AlO2-+NH3•H2O+2BaSO4↓ | |
| C. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
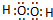 ,W第一步电离方程式为H2O2?H++HO2-.
,W第一步电离方程式为H2O2?H++HO2-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com