
分析 氯化铁为强酸弱碱盐,水解呈酸性,生成氢氧化铁,加热促进水解,灼烧时生成的氢氧化铁分解生成氧化铁,以此解答该题.
解答 解:FeCl3为强酸弱碱盐,水溶液呈酸性,原因是发生Fe3++3H2O?Fe(OH)3+3H+,
实验室配制FeCl3的水溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解;加热促进水解,灼烧时生成的氢氧化铁分解生成氧化铁,
故答案为:酸性;Fe3++3H2O?Fe(OH)3+3H+;Fe2O3.
点评 本题考查了盐类水解的应用等知识点,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意把握水解的原理以及影响因素,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 该混盐具有和漂白粉相似的化学性质 | |
| B. | 该混盐的水溶液呈中性 | |
| C. | 该混盐与硫酸反应生成1摩尔氯气时,转移了1摩尔电子 | |
| D. | 该混盐中氯元素的化合价为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
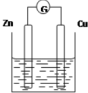 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Na+、SO42- | B. | H+、Fe2+、Na+、NO3- | ||
| C. | Ba2+、K+、Al3+、HCO3- | D. | NH4+、Li+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com