
| A. | ③④⑤⑥⑦⑧ | B. | ④⑤⑧ | C. | ④⑤⑦⑧ | D. | ③④⑤⑧ |
分析 既能使酸性KMnO4溶液褪色又能与溴水反应使之褪色,应为烯烃或炔烃类物质,以此来解答.
解答 解:①甲烷均不能使高锰酸钾、溴水反应而褪色,故不选;
②苯均不能使高锰酸钾、溴水反应而褪色,故不选;
③聚丙烯中不含碳碳双键,均不能使高锰酸钾、溴水反应而褪色,故不选;
④聚1,3-丁二烯中含碳碳双键,既能使酸性KMnO4溶液褪色又能与溴水反应使之褪色,故选;
⑤2-丁炔中含碳碳三键,既能使酸性KMnO4溶液褪色又能与溴水反应使之褪色,故选;
⑥环己烷均不能使高锰酸钾、溴水反应而褪色,故不选,故不选;
⑦邻二甲苯能被高锰酸钾氧化,而不能与溴水反应褪色,故不选;
⑧裂解气中含不饱和烃,则既能使酸性KMnO4溶液褪色又能与溴水反应使之褪色,故选,
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握不饱和烃的性质为解答的关键,注意苯的同系物不与溴水反应,注重基础知识的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①② | C. | ①④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CrO42-和S2-在酸性溶液中可大量共存 | |
| B. | 实验②说明氧化性:Cr2O72->SO42- | |
| C. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 | |
| D. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质参加的化合反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应一定是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 有单质参加或生成的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
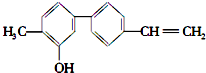
| A. | 由于含有氧元素不是有机物 | B. | 该物质的分子式是 C15H14O | ||
| C. | 分子中含有羟基属于醇 | D. | 分子中有三种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液加水稀释醋酸的电离程度增大 | |
| B. | 工业合成氨时常用通过过量的氮气的方法提高氢气的转化率 | |
| C. | 新制的氯水在光照的条件下颜色变浅 | |
| D. | 氯化铁溶液中加Fe粉振荡后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是CH2=CH2 B是CH3CHO C是CH3CH2OH | |
| B. | A是CH3CHO B是CH2=CH2C是CH3CH2OH | |
| C. | A是CH≡CH B是CH3CH2OH C是CH3CHO | |
| D. | A是CH3CH2OH B是CH3-CH3C是CH≡CH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com