
| A. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 铜丝插入稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| C. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
分析 A.HCl是弱电解质,要写化学式;
B.稀硝酸和Cu反应生成可溶性的硝酸铜、NO和水;
C.二者发生氧化还原反应生成硫酸钠、HCl;
D.二者反应生成氢氧化铝和碳酸氢钠.
解答 解:A.HCl是弱电解质,要写化学式,离子方程式为Cl2+H2O=H++Cl-+HClO,故A错误;
B.稀硝酸和Cu反应生成可溶性的硝酸铜、NO和水,离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故B正确;
C.二者发生氧化还原反应生成硫酸钠、HCl,离子方程式为ClO-+H2O+SO2═2H++Cl-+SO42-,故C错误;
D.二者反应生成氢氧化铝和碳酸氢钠,离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故D错误;
故选B.
点评 本题考查离子方程式书写,为高频考点,侧重考查学生离子方程式书写方法的掌握和灵活运用,要遵循客观事实、原子守恒、电荷守恒、转移电子守恒,知道哪些物质写离子哪些写化学式,题目难度不大.


科目:高中化学 来源: 题型:实验题
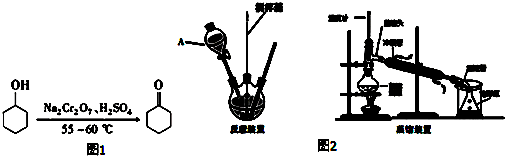
| 名称 | 性状 | 密度 | 溶点℃ | 沸点℃ | 溶解度 | |
| 水 | 乙醚 | |||||
| 环已醇 | 无色,有刺激性气味 | 0.9624 | 25.93 | 161.5 | 5.67g/100mL | ∞ |
| 环已酮 | 无色,有刺激性气味 | 0.9478 | - | 155.7 | 2.4g/100mL | ∞ |
 +1 Na2Cr2O7+4H2SO4→3
+1 Na2Cr2O7+4H2SO4→3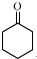 +1 Na2SO4+1 Cr2(SO4)3+7 H2O
+1 Na2SO4+1 Cr2(SO4)3+7 H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油失火时,立即用水灭火 | |
| B. | 实验室不小心碰翻酒精灯引起实验桌上洒落的少量酒精起火时,迅速用泡沫灭火器灭火 | |
| C. | 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤 | |
| D. | 浓 NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是:胶体粒子直径在1-100nm之间 | |
| B. | 一定温度、压强下,气体体积由其分子的大小决定 | |
| C. | 氧化还原反应的本质是电子转移 | |
| D. | 在1L2mol/L的氢氧化铁胶体中含有氢氧化铁胶粒数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
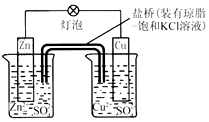
| A. | 负极反应为:2n-2e -═2n2+ | B. | 电池反应为:Zn+Cu2+═Zn2++Cu | ||
| C. | 盐桥中酌K+移向ZnSO4溶液 | D. | 在外电路中,电子从负极流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
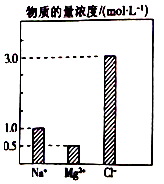 在0.2L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分,下列说法不正确的是( )
在0.2L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分,下列说法不正确的是( )| A. | NaCl的物质的量为0.2mol | |
| B. | 溶质MgCl2的质量为9 g | |
| C. | 该混合液中BaCl2的物质的量为0.1mol | |
| D. | 将该混合液加水稀释至体积为1 L,稀释后溶液中的Ba2+物质的量浓度为0.1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com