
 ,元素C为Na,处于第3周期ⅠA族,
,元素C为Na,处于第3周期ⅠA族, ;第三周期ⅠA族;
;第三周期ⅠA族;

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
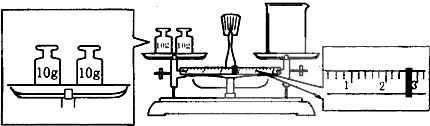
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、5% | B、17% |
| C、25% | D、33% |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、蒸发时,蒸发皿内所盛液体不超过蒸发皿容积的
| ||
| B、蒸发结晶时,不能直接蒸干液体,最后少量液体用余热蒸干 | ||
| C、用四氯化碳萃取碘水中的碘,分液时四氯化碳碘溶液从上口倒出 | ||
| D、蒸馏时,要在烧瓶中加入几粒碎瓷片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠着火燃烧时,用泡沫灭火器灭火 |
| B、硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 |
| C、在新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液最终呈红色 |
| D、向Ba(OH)2溶液中慢慢滴加稀硫酸至过量,溶液的导电性变化是弱→强→弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③④ |
| C、②③④ | D、①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com