
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
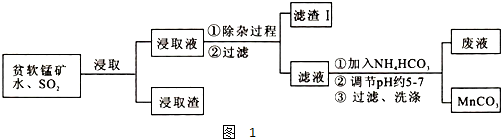
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化铝 | 3.3 | 5.2 |
| 氢氧化亚铁 | 7.6 | 9.6 |
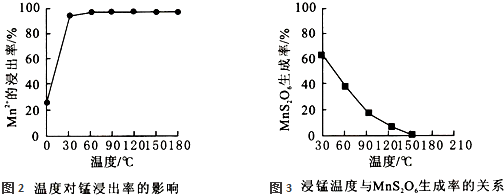
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称量前先调节托盘天平的零点 |
| B、潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 |
| C、用托盘天平只能称量至0.1g |
| D、称量时左盘放被称量物,右盘放砝码 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是物质的数量单位 |
| B、58.5gNaCl溶解在1L水中,得到溶液的物质的量浓度为1mol/L |
| C、标况下,1molCCl4所占的体积约为22.4L |
| D、12g12C含有的碳原子数约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8 | B、6 | C、4 | D、2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 molH2的质量是1 g |
| B、1 mol HCl的质量是36.5 g?mol-1 |
| C、Cl2的摩尔质量等于它的相对分子质量 |
| D、硫酸根离子的摩尔质量是96 g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
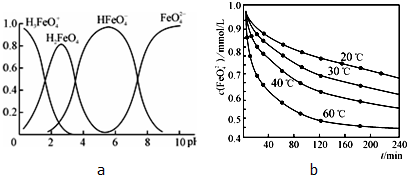
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com