
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式:2NO+2CO 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO) /mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO) /mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)若1molNO和1molCO的总能量比1molCO2和0.5molN2的总能量大,则上述反应的![]() ___0(填写“>”、“<”、“=”)。
___0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)计算4s时NO的转化率为____________。
(4)下列措施能提高NO和CO转变成CO2和N2的反应速率的是______(填序号)。
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(5)由上表数据可知,该反应在第______s达到化学平衡状态。假如上述反应在密闭恒容容器中进行,判断该反应是否达到平衡的依据为________(填序号)。
A.压强不随时间改变B.气体的密度不随时间改变
C.c(NO)不随时间改变D.单位时间里消耗NO和CO的物质的量相等
(6)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 催化剂的比表面积/m2·g-1 |
Ⅰ | 280 | 1.20×10-3 | 82 | |
Ⅱ | 5.80×10-3 | 124 | ||
Ⅲ | 350 | 124 |
①请在上表格中填入剩余的实验条件数据_____、_____、______、______、______。
②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号________。
【答案】< 1.875![]() 10-4mol·L-1·s-1 90% ABD 4 AC 5.80
10-4mol·L-1·s-1 90% ABD 4 AC 5.80![]() 10-3 280 1.20
10-3 280 1.20![]() 10-3 1.20
10-3 1.20![]() 10-3 5.80
10-3 5.80![]() 10-3
10-3 
【解析】
反应热的正负可根据反应物和生成物的总能量的大小比较;能提高反应速率的因素主要有增大浓度、使用催化剂、升高温度、增大表面积、构成原电池等,压强能否改变反应速率要看是否改变了浓度;反应是否达到平衡可以从速率(正逆反应速率是否相等)、量(是否保持不变)、压强、气体平均密度,气体平均摩尔质量、颜色等方面判断;验证多个因素对化学反应速率的影响规律,要控制变量做对比实验,每组对比实验只能有一个变量。
(1)反应物比生成物的总能量大,说明是放热反应,![]() <0;
<0;
(2)V(N2)=0.5V(NO)= ![]() =1.875
=1.875![]() 10-4mol· L-1· s-1。
10-4mol· L-1· s-1。
(3)NO的转化率等于反应掉的NO除以原有总的NO,可列式![]() =90% 。
=90% 。
(4)催化剂可以加快反应速率,A正确;温度越高,反应速率越快,B正确,C错误;缩小容器体积,会增大各组分的浓度,浓度越高,反应速率越快,D正确。
故答案选ABD;
(5)由表中数据可知,第4s后,反应物的浓度不再变化,达到平衡;
A.恒温恒压下,压强不变意味着气体的总物质的量不变,而该反应两边的气体计量数之和不同,气体的总物质的量不变说明达到平衡,A正确;
B.气体的密度等于气体的质量除以体积,因为所有组分都是气体,气体的质量不变,因为恒容容器,所以气体不变,所以气体的密度永远不变,与平衡没有关系,B错误;
C.c(NO)不变,意味着达到平衡,C正确;
D.因为NO和CO的化学计量数之比为1:1,且都是反应物,所以单位时间里消耗NO和CO的物质的量一定相等,不能说明达到平衡,D错误;
故答案:4;AC;
(6)①验证多个因素对化学反应速率的影响规律,要控制变量做对比实验。I和II因为催化剂的比表面积不同,所以其他条件应该是一样的,研究的是催化剂比表面积对化学反应速率的影响规律;II和III因为温度不一样,所以其他条件应该是一样的,研究的是温度对化学反应速率的影响规律;
故答案是:5.80![]() 10-3 ,280,1.20
10-3 ,280,1.20![]() 10-3 ,1.20
10-3 ,1.20![]() 10-3 ,5.80
10-3 ,5.80![]() 10-3 ;
10-3 ;
②I和II的区别是催化剂的比表面积,催化剂加快反应速率,所以II更快的达到平衡,但催化剂不影响平衡,所以I和II平衡时NO的浓度一样,c(NO)变化曲线如图: 。
。


科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是

A. 水很稳定(1000℃以上才会部分分解),但与水中含有大量氢键无关
B. [Cu(NH3)4]SO4和(NH4)2SO4两种物质中都有配位键,所以都是配合物
C. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
D. 由如图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答:

(1)从氯化钾溶液中得到氯化钾固体,选择装置_____(填代表装置图的字母,下同),除去自来水中的Cl-等杂质,选择装置______。
(2)从碘水中分离出I2,选择装置______,该分离方法的名称为______。
(3)装置A中①的名称是_______。进水的方向是从______口进水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)。已知: ①C7H8(l)(NBD)+9O2(g)=7CO2(g)+4H2O(l) ΔH1,②C7H8(l)(Q)+9O2(g)=7CO2(g)+4H2O(l) ΔH2,③
![]()
![]() ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
A. ΔH1>ΔH2 B. NBD的能量比Q的能量高
C. NBD比Q稳定 D. NBD转化为Q是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物与人类生活密不可分,生活中的一些问题常涉及化学知识。
(1)有下列几种食品:

①花生油中所含人体所需的主要营养物质为___________(填“糖类”、“油脂”或“蛋白质”)。
②吃饭时,咀嚼米饭一会儿后感觉有甜味,是因为淀粉发生了_____________(填字母)反应。
A.分解 B.水解 C.裂解
(2)在日常生活中,下列做法错误的是________。
A.用燃烧法鉴别毛织品和棉织品
B.用纯碱洗涤锅盖上的油渍
C.用闻气味的方法鉴别白酒和米醋
D.用淀粉溶液鉴别加碘食盐和不含碘的食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温下气体反应达到化学平衡,平衡常数K=![]() ,恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
,恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
A.降低温度,正反应速率增大
B.增大c(A)、c(B),K增大
C.向容器中充入稀有气体X,压强增大,反应速率不变
D.该反应的化学方程式为2E(g)+F(s)![]() A(g)+2B(g)
A(g)+2B(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的世界缤纷多彩,苯乙烯在一定条件下有如图转化关系,根据框图回答下列问题:
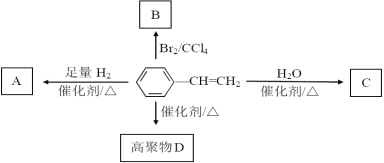
![]() 苯乙烯与
苯乙烯与![]() 的
的![]() 生成B的实验现象为______,
生成B的实验现象为______,![]() 苯乙烯最多能和含________
苯乙烯最多能和含________![]() 的
的![]() 溶液反应。
溶液反应。
![]() 苯乙烯生成高聚物D的的化学方程式为_____,该反应类型是_____。
苯乙烯生成高聚物D的的化学方程式为_____,该反应类型是_____。
![]() 苯乙烯与水反应生成C的可能生成物有________、________,其中分子中含有“
苯乙烯与水反应生成C的可能生成物有________、________,其中分子中含有“![]() ”的有机物在铜作催化剂和加热的条件下发生氧化反应的化学方程式为________。
”的有机物在铜作催化剂和加热的条件下发生氧化反应的化学方程式为________。
![]() 苯乙烯与足量
苯乙烯与足量![]() 一定条件下充分反应的生成物A的分子式为________,A的二氯代物有________种,有机物
一定条件下充分反应的生成物A的分子式为________,A的二氯代物有________种,有机物![]()
![]() 正二十烷
正二十烷![]() 存在于烤烟烟叶中,正二十烷与A的关系是________。
存在于烤烟烟叶中,正二十烷与A的关系是________。
A.同分异构体 ![]() 同系物
同系物 ![]() 同素异形体
同素异形体 ![]() 都不是
都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氢氧化钠固体配制1.00mol·L-1的NaOH溶液500mL,回答下列问题。
(1)关于容量瓶的使用,下列操作正确的是________(填字母)。
a.使用前要检验容量瓶是否漏液
b.用蒸馏水洗涤后必须要将容量瓶烘干
c.为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行
d.为了使所配溶液浓度均匀,定容结束后,要摇匀
e.用500mL的容量瓶可以直接配制480mL溶液
f.当用容量瓶配制完溶液后,可用容量瓶存放所配制的试剂
(2)请补充完整实验的简要步骤。
①计算;②称量NaOH固体________g;③溶解;④冷却并移液;⑤洗涤并转移;⑥________;⑦摇匀。
(3)本实验用到的基本仪器已有烧杯、天平(带砝码)、镊子、量筒、玻璃棒,还缺少的仪器是________、________。
(4)上述实验操作②③都要用到小烧杯,其作用分别是_____________________和_______。
(5)如图是该同学转移溶液的示意图,图中有两处错误,请写出:
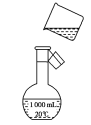
①____________________________________________;
②_____________________________________________。
(6)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________(填字母)。
A.转移溶液时不慎有少量液体洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀,静置后,发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质:①Cu ②NaCl晶体 ③NaHSO4 ④CO2 ⑤稀H2SO4 ⑥C2H5OH属于电解质的是(填序号,下同)_____,属于非电解质的是_____。
(2)写出下列物质在水溶液中的电离方程式:
①NaHSO4 _______;
②Al2(SO4)3 _______;
(3)按要求写出下列方程式:
①写出硫酸铜溶液中滴加氢氧化钠溶液的反应的离子方程式:_____________。
②写出能用离子方程式CO![]() +2H+=CO2↑+H2O表示的一个化学方程式:__________。
+2H+=CO2↑+H2O表示的一个化学方程式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com