
| A. | 高纯硅可作计算机芯片的材料 | |
| B. | 洁厕灵的主要成分是盐酸,不能与“84”消毒液(主要成分是NaClO)混用 | |
| C. | PM2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | Na2SiO3溶液可做木材防火剂 |
分析 A.计算机芯片芯片的成分硅单质;
B.洁厕灵(含盐酸)和84消毒液(含次氯酸钠)进行混用,会产生有毒气体氯气;
C.胶体粒子的直径介于1nm~100nm之间;
D.木材和织物用水玻璃浸泡后既可防腐又不易着火.
解答 解:A.高纯硅可以作计算机芯片材料,故A正确;
B.洁厕灵(含盐酸)和84消毒液(含次氯酸钠)进行混用,会产生有毒气体氯气,所以不能与“84“消毒液混用,故B正确;
C.胶体粒子的直径介于1nm~100nm之间,PM2.5是指大气中直径≤2.5×10-6m的颗粒物,不一定为胶体,故C错误;
D.木材和织物用水玻璃浸泡后既可防腐又不易着火,可做木材防火剂,故D正确.
故选C.
点评 本题考查化学与社会、环境的关系,把握常见物质的性质以及用途为解答的关键,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热的纯碱溶液去污能力增强 | |
| B. | 配制FeCl3溶液,可加入少量的稀硫酸,以防止溶液浑浊 | |
| C. | 加热蒸干Al2(SO4)3溶液,最终能得到Al2(SO4)3晶体 | |
| D. | 利用明矾净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| C. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 | |
| D. | Fe3+与KSCN产生红色沉淀,铁与水蒸气在高温下的反应产物为Fe3O4和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
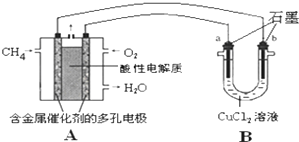
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com