
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
 电石气的结构式H-C≡C-H
电石气的结构式H-C≡C-H .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓烧碱溶液中加入铝片:Al+2OH-═AlO2-+H2↑ | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,使SO42-全部沉淀:2Al3++6OH-+3SO42-+3Ba2+=2Al(OH)3↓+3BaSO4↓ | |
| C. | 在2 mol/L FeBr2溶液80 mL中通入4.48 L氯气(标况下),充分反应:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子的球棍模型: | |
| B. | COCl2的电子式: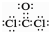 | |
| C. | 质子数为6、质量数为14的原子:${\;}_{6}^{14}$N | |
| D. | 熔融状态下硫酸氢钾的电离方程式:KHSO4(熔融)→K++H++SO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
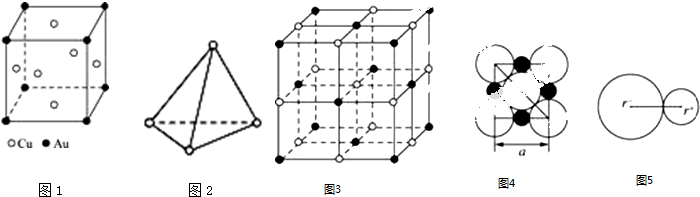
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com