
| A. | ①②③⑤ | B. | ③⑥ | C. | ③ | D. | ③⑤ |
分析 若要使平衡逆向移动,同时使c(OH-)增大,则可加入能电离出氢氧根离子的物质,结合浓度对化学平衡的影响来解答.
解答 解:①NH4Cl固体,铵根离子浓度增大,平衡逆向移动,c(OH-)减小,故错误;
②硫酸会消耗氢氧根离子,氢氧根离子浓度减小,平衡正向移动,故错误;
③NaOH固体,溶液中氢氧根离子浓度增大,电离平衡逆向移动,故正确;
④水稀释,氨水的浓度减小,平衡正向移动,氢氧根离子浓度减小,故错误;
⑤加热促进一水合氨的电离,则电离平衡正向移动,氢氧根离子浓度增大,故错误;
⑥加入少量MgSO4固体,氢氧根离子与镁离子反应生成氢氧化镁沉淀,平衡正向移动,氢氧根离子浓度减小,故错误;
故选C.
点评 本题考查电离平衡的影响因素,注意把握浓度对电离平衡的影响为解答的关键,明确逆向移动及[OH-]增大均满足即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
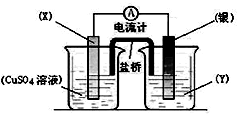
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
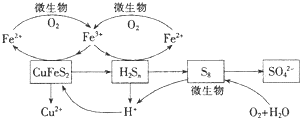
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在3支试管中分别放有:①1mL乙酸乙酯和3mL水 ②1mL四氯化碳和3mL水 ③1mL乙酸和3mL水.图中三支试管从左到右的排列顺序为( )
在3支试管中分别放有:①1mL乙酸乙酯和3mL水 ②1mL四氯化碳和3mL水 ③1mL乙酸和3mL水.图中三支试管从左到右的排列顺序为( )| A. | ①②③ | B. | ①③② | C. | ②①③ | D. | ②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com