
【题目】A、B、C、D、E为同一周期原子序数依次增大的短周期主族元素,已知A、B、D三种原子最外层共有10个电子,且这三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的核电荷数是最外层电子数的3倍。
(1)A的单质在空气中燃烧的产物为____填化学式)。
(2)D、E的最高价氧化物的水化物的酸性比较:_______ (用化学式表示)。
(3)元素E形成的单质通入D的一种氧化物的水溶液中发生反应,生成两种常见的强酸。该反应的化学方程式为____。
(4)写出B、A两元素的最高价氧化物的水化物相互反应的离子方程式:____。
【答案】Na2O2 HClO4>H2SO4 Cl2+ SO2+2H2O = 2HCl + H2SO4 Al(OH)3+ OH-=AlO![]() + 2H2O
+ 2H2O
【解析】
A、B、C、D、E为同一周期原子序数依次增大的短周期主族元素,C元素的核电荷数是最外层电子数的3倍,C是P元素;氢氧化铝具有两性,既能和强酸反应又能和强碱反应,A、B、D三种原子最外层共有10个电子,且这三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,说明A、B、D中一定含有Al元素, 则A是Na元素、B是Al元素,D是S元素、E是Cl元素。
(1)A是Na元素,钠在空气中燃烧的产物为过氧化钠,化学式是Na2O2;
(2)D是S元素、E是Cl元素,同周期元素从左到右非金属性增强,所以最高价氧化物的水化物的酸性:HClO4>H2SO4;
(3)E是Cl元素,氯气和二氧化硫的水溶液反应生成硫酸和盐酸,该反应的化学方程式为Cl2+ SO2+2H2O=2HCl + H2SO4;
(4)Al、Na两元素的最高价氧化物的水化物分别是Al(OH)3、NaOH,Al(OH)3、NaOH反应生成偏铝酸钠和水,反应的离子方程式是Al(OH)3+ OH-=AlO![]() + 2H2O。
+ 2H2O。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】![]() △H =akJ/mol ;
△H =akJ/mol ;![]() △H =bkJ/mol。P4具有正四面体结构,PCl5 中 P-Cl 键的键能为cKJ/mol、,PCl3 中 P-Cl 键的键能为1.2cKJ/mol。下列叙述正确的是( )
△H =bkJ/mol。P4具有正四面体结构,PCl5 中 P-Cl 键的键能为cKJ/mol、,PCl3 中 P-Cl 键的键能为1.2cKJ/mol。下列叙述正确的是( )
A.P-P 键的键能大于P-Cl 键的键能
B.可求 ![]() 的反应热 △H
的反应热 △H
C.P-P 键的键能为 ![]()
D.Cl-Cl 键的键能 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F是重要的有机化工原料。烃A的产量是一个国家石油化工发展水平的标志,A的相对分子质量为28。B可用作燃料和溶剂。F为有香味的油状液体。它们之间的转化关系如下图。
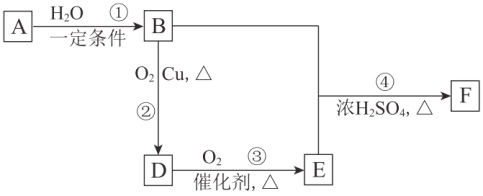
(1)A的结构简式是______。反应①属于______(填反应类型)。
(2)B的官能团是______。
(3)反应②的化学方程式是______。
(4)反应④的化学方程式是______。
(5)下列说法不正确的是______(填序号)。
a.A、B均不能被酸性高锰酸钾溶液氧化
b.用饱和Na2CO3溶液能除去F中混有的少量B、E
c.生活中可以用E除去水壶中的水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将![]() mol
mol![]() 固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
A.加入50mL1![]() ,反应结束后,
,反应结束后,![]()
B.加入![]() molCaO,溶液中
molCaO,溶液中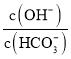 减小
减小
C.加入50mL![]() ,由水电离出的
,由水电离出的![]() 增大
增大
D.加入![]() mol
mol![]() 固体,反应完全后,溶液呈中性
固体,反应完全后,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制物质的量浓度为0.1 mol·L-1的Na2CO3溶液100 mL时,下列操作正确的是( )
A. 用托盘天平称取1.06 g无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中
B. 在使用容量瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水
C. 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分
D. 定容时,若仰视,则所配溶液的浓度将偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
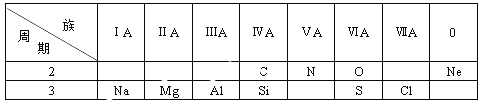
(1)金属性最强的元素是___________;
(2)最外层电子数为8的原子是___________;
(3) O和S二者原子半径较大的是___________;
(4)可用于制造光导纤维的氧化物是___________;
(5)CH4和SiH4二者热稳定性较强的是___________;
(6)MgO和Al2O3中,能与强碱溶液反应的是_____________;
(7)NaOH和Mg(OH)2中,碱性较弱的是___________;
(8)NO在空气中会变成红棕色的NO2,写出该反应的化学方程式___________;
(9)HClO4中氯元素的化合价是______;1mol HClO4含有_________mol O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式________________________________
(2)过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式_________;氧化产物与还原产物的物质的量之比为________。
(3)除去废液中的AsCl3,是用次磷酸钠(NaH2PO2)还原AsCl3,产生了棕色单质砷沉淀和H3PO3。该反应的化学反应方程式为______________________氧化剂和还原剂的物质的量之比为________,氧化产物是________。
(4)FeS被水溶液中Cl2氧化,氧化后的溶液中滴加BaCl2有不溶解于盐酸的白色沉淀生成,则水溶液中FeS与Cl2反应的离子方程式为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对各电解质溶液的分析正确的是( )
A.硫酸铁溶液中能大量共存的离子:K+、Na+、NO3-、CO32-
B.Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.0.1molL﹣1Na2S溶液中存在:c(OH-)=c(H+)+c(HS﹣)+2c(H2S)
D.NH4HSO4溶液呈酸性的主要原因是:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示与对应叙述相符的是![]()

A.图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则![]()
B.图乙表示![]() 的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸
的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸![]() 乙酸
乙酸
C.图丙是用![]() 0
0![]() 溶液滴定
溶液滴定![]() mL盐酸的滴定曲线
mL盐酸的滴定曲线
D.图丁表示反应![]() 平衡时
平衡时![]() 体积分数随起始
体积分数随起始![]() 变化的曲线,则转化率:
变化的曲线,则转化率:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com