
 醋酸由于成本较低,在生产中被广泛应用.
醋酸由于成本较低,在生产中被广泛应用.分析 (1)醋酸是弱酸存在电离平衡,CH3COOH(aq)与NaOH(aq)反应可分为两步:①CH3COOH在水溶液中电离CH3COOH?H++CH3COO-;②产生的H+与NaOH(aq)反应,利用盖斯定律进行计算,可得CH3COOH在水溶液中电离的反应热;
(2)电离度α=$\frac{已电离的醋酸分子}{醋酸分子总数}$×100%;CH3COOH的电离平衡常数Ka=$\frac{c({H}^{+})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$,以此解答该题;
(3)根据化学平衡状态的特征分析,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化;
(4)①压强越大,反应速率越大;
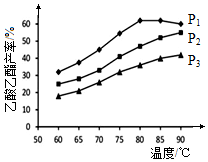
②压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30%,依据化学平衡三行计算劣势计算得到,转化率=$\frac{消耗量}{起始量}$×100%;
③在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降,说明升温平衡逆向进行;
④选择适宜条件使得乙酸乙酯产率达到最大,为提高乙酸乙酯的合成速率和产率,赢是改变的条件加快反应速率且平衡正向进行.
解答 解:(1)醋酸是弱酸存在电离平衡,电离方程式为:CH3COOH?CH3COO-+H+
CH3COOH(aq)+OH-(aq)═CH3COO-(aq)+H2O(l)△H=-46.8kJ•mol-1 ①
H+(aq)+OH-(aq)═H2O(l)△H=△H=-55.6kJ•mol-1 ②
用①-②可得CH3COOH电离的热化学方程式为:CH3COOH(aq)?H+(aq)+CH3COO-(aq)△H=-46.8kJ•mol-1-(-55.6kJ•mol-1)=+8.8kJ•mol-1,
故答案为:CH3COOH?CH3COO-+H+;+8.8;
(2)由CH3COOH?CH3COO-+H+知,c(H+)等于已经电离的c(CH3COOH),所以已经电离的醋酸浓度是0.1×1.5%mol/L,
由CH3COOH?CH3COO-+H+知,c(H+)=c(CH3COO-)=已经电离的c(CH3COOH),
溶液中未电离的醋酸浓度为,
Ka=$\frac{c({H}^{+})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{(0.1×1.5%)^{2}}{0.1×(1-1.5%)}$,
故答案为:$\frac{(0.1×1.5%)^{2}}{0.1×(1-1.5%)}$;
(3)A.乙烯、乙酸、乙酸乙酯的浓度相同不能说明正逆反应速率相同,故意A错误;
B.酯化合成反应的速率与酯分解反应的速率相等,说明正逆反应速率相同,故B正确;
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,只能说明反应正向进行,故C错误;
D.体系中乙烯的百分含量一定是平衡标志,故D正确;
故答案为:BD;
(4)①CH2═CH2(g)+CH3COOH(l)$\stackrel{杂多酸}{?}$CH3COOC2H5(l),温度一定压强增大平衡正向进行,反应速率增大,图象分析可知P1>P2>P3,则温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是v(P1)>v(P2)>v(P3),
故答案为:v(P1)>v(P2)>v(P3);其它条件相同时,对有气体参与的反应,压强越大化学反应速率越快;
②CH2═CH2(g)+CH3COOH(l)$\stackrel{杂多酸}{?}$CH3COOC2H5(l),
起始量(mol) 1 1 0
变化量(mol) x x x
平衡量(mol) 1-x 1-x x
弱乙烯全部转化生产乙酸乙酯1mol,若乙酸乙酯的产率为30%,则生成乙酸乙酯0.3mol,所以消耗乙烯0.3mol,
乙烯的转化率=30%,
故答案为:30%;
③在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是:由图象可知,P1 MPa、80℃时反应已达平衡且正反应放热,故压强不变升高温度平衡逆向移动产率下降
故答案为:由图象可知,P1 MPa、80℃时反应已达平衡且正反应放热,故压强不变升高温度平衡逆向移动产率下降;
④选择适宜条件使得乙酸乙酯产率达到最大,图象中乙酸乙酯产率最大的条件是:P1 MPa、80℃,为提高乙酸乙酯的合成速率和产率,赢是改变的条件加快反应速率且平衡正向进行,可以增大反应物浓度或增大压强等,
故答案为:P1 MPa、80℃; 通入乙烯气体或增大压强.
点评 本题考查了弱电解质电离平衡、热化学方程式书写、电离平衡常数计算、平衡影响因素和图象分析判断,平衡移动原理是解题关键,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸碱滴定时,眼睛一定要注视滴定管中液面的变化 | |
| B. | 实验室制乙烯时,为使受热均匀,应轻轻搅动温度计 | |
| C. | 测溶液酸碱性时,须将PH试纸浸入待测液中 | |
| D. | 分液时,下层液体先从分液漏斗下口放出,上层液体后从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业合成氯化氢时使用过量氢气 | |
| B. | 硫酸工业接触室中使用过量空气 | |
| C. | 合成氨工业采用20~50 MPa高压 | |
| D. | 侯氏制碱法向母液中加入氯化钠提取氯化铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O→Ca(OH)2 | B. | 2Na+2H2O→2NaOH+H2↑ | ||
| C. | 2F2+2H2O→4HF+O2 | D. | 2H2+O2$\stackrel{点燃}{→}$2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W试剂 | 实验现象 | X、Y离子的推测 | |
| A | KI-淀粉溶液 | 溶液变蓝 | Fe3+、SO42- |
| B | 用pH试纸检测 | pH=7(常温) | CH3COO-、Na+ |
| C | 硝酸酸化的AgNO3溶液 | 白色沉淀 | CO32-、NH4+ |
| D | 过量NaOH溶液 | 无明显现象 | Al3+、Mg2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CH4含有的共价键数为NA | |
| B. | 1 mol Fe与1mol Cl2充分反应,电子转移数为3NA | |
| C. | 常温下,pH=2的醋酸溶液中含有的H+数目为0.02NA | |
| D. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量 | B. | 密度 | C. | 碳原子数 | D. | 原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制漂白粉:Cl2+2NaOH═NaCl+NaClO+H2O | |
| B. | 工业制粗硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO | |
| C. | 工业合成氨:N2+3H2 $?_{催化剂}^{高温高压}$ 2NH3 | |
| D. | 工业炼铁:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com