练习册系列答案
相关习题
科目:高中化学
来源:
题型:
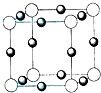
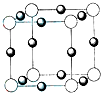
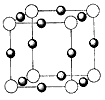
(2011?平顶山二模)A、B、C、D、E五种前四周期元素,原子序数依次增大.已知D元素原子核外的M层上有3个单电子存在.在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置.回答下列问题:
(1)元素E的元素符号为
As
As
,最高正价为
+5
+5
,最外层电子构型为
4s24p3
4s24p3
;
(2)C的常见氯化物中,C元素的杂化类型为
sp3
sp3
,A元素在其含氧酸根离子中的杂化类型为
sp2
sp2
,A、C两元素所形成化合物的晶体类型是
原子晶体
原子晶体
;
(3)D的氢化物的立体结构呈
三角锥
三角锥
型,该氢化物比元素B的氢化物沸点低的原因是
B元素的氢化物之间存在有氢键
B元素的氢化物之间存在有氢键
.
(4)元素B的离子(B
3-)与某金属离子(X
+)形成化合物的晶胞结构如图所示.则晶胞中顶点上的小球应代表
B3-
B3-
(填“B
3-”或“X
+”).
查看答案和解析>>
科目:高中化学
来源:
题型:
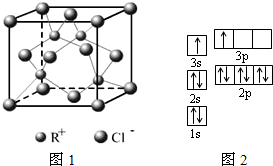
(1)下列是部分金属元素的电离能
|
X |
Y |
Z |
| 第一电离能(kJ/mol) |
520.2 |
495.8 |
418.8 |
①已知X、Y、Z的价层电子构型为ns
1,则三种金属的氯化物(RCl)的熔点由高到低的顺序为
ZCl<YCl<XCl
ZCl<YCl<XCl
.
②RCl用作有机合成催化剂,并用于颜料、防腐等工业.R
+中所有电子正好充满K、L、M三个电子层,它与Cl
-形成的晶体结构如图1所示.R的元素符号是
Cu
Cu
,与同一个Cl
-相连的R
+有
4
4
个.
(2)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
①某同学根据上述信息,推断B的核外电子排布如图2所示,所画的电子排布图违背了
能量最低原理
能量最低原理
.
②A和氯元素形成的简单分子为
非极性分子
非极性分子
(填“极性分子”或“非极性分子”).
(3)氢气作为一种清洁能源,必须解决它的储存问题,C
60可用作储氢材料.
已知金刚石中的C-C的键长为154.45pm,C
60中C-C键长为145~140pm,有同学据此认为C
60的熔点高于金刚石,你认为是否正确
否
否
(填“是”或“否”),并阐述理由
因为金刚石是原子晶体,而C60是分子晶体
因为金刚石是原子晶体,而C60是分子晶体
.
查看答案和解析>>
科目:高中化学
来源:平顶山二模
题型:问答题
A、B、C、D、E五种前四周期元素,原子序数依次增大.已知D元素原子核外的M层上有3个单电子存在.在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置.回答下列问题:
(1)元素E的元素符号为______,最高正价为______,最外层电子构型为______;
(2)C的常见氯化物中,C元素的杂化类型为______,A元素在其含氧酸根离子中的杂化类型为______,A、C两元素所形成化合物的晶体类型是______;
(3)D的氢化物的立体结构呈______型,该氢化物比元素B的氢化物沸点低的原因是______.
(4)元素B的离子(B
3-)与某金属离子(X
+)形成化合物的晶胞结构如图所示.则晶胞中顶点上的小球应代表______(填“B
3-”或“X
+”).
查看答案和解析>>
科目:高中化学
来源:河南省模拟题
题型:推断题
A、B、C、D、E五种前四周期元素,原子序数依次增大。已知D元素原子核外的M层上有3个单电子存在。在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置。回答下列问题:
(1)元素E的元素符号为________,最高正价为_________,最外层电子构型为_____________;
(2)C的常见氯化物中,C元素的杂化类型为_____________,A元素在其含氧酸根离子中的杂化类型为
__________,A、C两元素所形成化合物的晶体类型是____________;
(3)D的氢化物的立体结构呈________型,该氢化物比元素B的氢化物沸点低的原因是____________。
(4)元素B的离子(B3-)与某金属离子(X+)形成化合物的晶胞结构如图所示。则晶胞中顶点上的小球应代表________(填“B3-”或“X+”)。
查看答案和解析>>
科目:高中化学
来源:2011年河南省平顶山市、新乡市、许昌市三市联考高考化学二模试卷(解析版)
题型:解答题
A、B、C、D、E五种前四周期元素,原子序数依次增大.已知D元素原子核外的M层上有3个单电子存在.在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置.回答下列问题:
(1)元素E的元素符号为______,最高正价为______,最外层电子构型为______;
(2)C的常见氯化物中,C元素的杂化类型为______,A元素在其含氧酸根离子中的杂化类型为______,A、C两元素所形成化合物的晶体类型是______;
(3)D的氢化物的立体结构呈______型,该氢化物比元素B的氢化物沸点低的原因是______.
(4)元素B的离子(B
3-)与某金属离子(X
+)形成化合物的晶胞结构如图所示.则晶胞中顶点上的小球应代表______(填“B
3-”或“X
+”).

查看答案和解析>>

 (2011?平顶山二模)A、B、C、D、E五种前四周期元素,原子序数依次增大.已知D元素原子核外的M层上有3个单电子存在.在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置.回答下列问题:
(2011?平顶山二模)A、B、C、D、E五种前四周期元素,原子序数依次增大.已知D元素原子核外的M层上有3个单电子存在.在周期表中,B、E与D同主族,A、C分别与B、D处于相邻位置.回答下列问题: (1)下列是部分金属元素的电离能
(1)下列是部分金属元素的电离能