
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同。已知:2NO2(g)![]() N2O4(g)△H<0。
N2O4(g)△H<0。
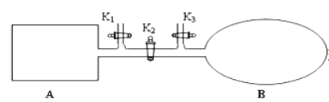
(1) 一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A)______________v(B) (填“<”、“>”或“=”);若打开活塞K2,气球B将______________(填“变大”、“变小”或“不变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将______________ 。若通入等量的Ne气,则达到平衡时,A中NO2的转化率将______________,B中NO2的转化率将______________。
(3)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的压强为原来的80%,试求出平衡时NO2的转化率______________。
【答案】< 变小 变大 不变 变小 40%
【解析】
(1)容器A体积不变,随反应进行,反应混合气体的物质的量减小,容器A中压强降低,容器B体积可变,压强不变,压强越大,反应速率越快;根据A中压强小于B中的压强来分析;
(2)保持容器容积不变,通入一定量的NO2,等效为增大压强到达的平衡,增大压强平衡向气体体积减小的方向移动,据此判断;保持压强不变,通入氖气使体系的容积增大一倍,反应混合物的浓度降低,相当于为降低压强,平衡向气体体积增大的方向移动;
(3)先根据公式求出n(NO2)=![]() ,再利用三段式和混合气体的压强变化,求出平衡时NO2的转化率。
,再利用三段式和混合气体的压强变化,求出平衡时NO2的转化率。
(1)容器A中压强降低,容器B体压强不变,压强越大,反应速率越快,所以v(A)<v(B),A中压强小于B中的压强,打开旋塞K,气球B的压强减小,体积减小,
因此,本题正确答案是:<;变小;
(2) 保持容器容积不变,通入一定量的NO2,等效为增大压强到达的平衡,增大压强平衡向气体体积减小的方向移动,NO2的转化率将增大;保持压强不变,通入氖气使体系的容积增大一倍,反应混合物的浓度降低,相当于为降低压强,平衡向气体体积增大的方向移动,达到平衡时NO2的转化率减小,但是对于A体系,体积不变,浓度不变,平衡不移动,
因此,本题正确答案是:变大;不变;变小;
(3)设参加反应的二氧化氮为xmol,n(NO2)=![]() =
=![]() =0.1mol
=0.1mol
2NO2(g)![]() N2O4(g)
N2O4(g)
起始量(mol) 0.1mol 0
反应量(mol) x ![]()
平衡量(mol) 0.1-x ![]()
平衡后容器内混合气体的压强为原来的80%,恒温恒容条件下,压强之比等于物质的量之比,则:![]() =0.8,解得x=0.04mol,
=0.8,解得x=0.04mol,
所以平衡时NO2的转化率=![]() 100%=40%,
100%=40%,
因此,本题正确答案是:40%。


科目:高中化学 来源: 题型:
【题目】在一条鱼、虾绝迹的小河边有四座工厂甲、乙、丙、丁(如下图),它们排出的废液里,每个工厂只有Na2CO3、CuCl2、Ca(OH)2、HCl中的一种。某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈浅蓝色浑浊;③丙处河水由浑变清;④丁处产生气泡,河水仍清,请推断:
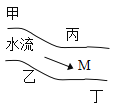
(1)四座工厂排除的废液里含有的污染物:甲____,乙_____,丙____,丁______。
(2)在M处取出的河水中,肯定含有的离子是______。
(3)写出有关离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠常用作食品防腐剂。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应生成气体的成分。

已知:N02和NO的沸点分别是21℃和-152℃。
回答下列问题:
(l)组装好仪器后,接下来进行的操作是 ___;装置C的作用是 ___。
(2)滴入硫酸前需要通入N2,其目的是 ___;实验结束后还需要继续通入N2的目的是____。
(3)关闭弹簧夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。确认A中还含有NO的依据是____;A中发生反应的化学方程式为_____。
(4)如果向D中通入过量O2,则装置E中发生反应的离子方程式为____;如果没有装置B,对实验结论造成的影响是 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列九种物质:①盐酸溶液 ②石墨 ③蔗糖 ④CO2⑤熔融NaHSO4⑥Ba(OH)2固体 ⑦氨水 ⑧纯硫酸 ⑨NaCl固体
(1)属于电解质的有__________;属于非电解质的有________;能导电的物质有________。
(2)②和SiO2在高温下可发生如下反应:3C+SiO2![]() SiC+2CO↑ (已知SiC中Si元素为+4价),上述反应中还原产物是_______;氧化剂与还原剂物质的量之比为_______。
SiC+2CO↑ (已知SiC中Si元素为+4价),上述反应中还原产物是_______;氧化剂与还原剂物质的量之比为_______。
(3)上述九种物质中有两种物质之间可发生离子反应:H++OH-===H2O,该离子反应对应的化学方程式为________________________
(4)⑤的电离方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、磷及其化合物是非常重要的物质。
(1)Cu+的电子排布式____;
(2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-。[Cu(CN)4]2-的配体为____,[Cu(CN)4]2-中C的杂化方式为____,则1个[Cu(CN)4]2-中含有的σ键的数目为____个;
(3)锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,不溶于水,可通过Na3PO4、CuSO4和NH3·H2O反应制取。制取Cu4O(PO4)2的化学方程式为____;
(4)PCl5中P-Cl键长有198pm和206pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,写出一种阳离子的等电子体的化学式____,PCl5的立体构型为____;
(5)金属铜属于面心立方晶体,铜的密度为ag·cm3,NA表示阿伏伽德罗常数,则铜的配位数____,铜的金属半径为___pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2-苯基丙烯 ,下列说法错误的是
,下列说法错误的是
A. 分子式为C9H10
B. 一定条件下,可以发生取代、加成和氧化反应
C. 1 mol该化合物最多可与4mol氢气发生加成反应
D. 分子中最多有8个碳原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
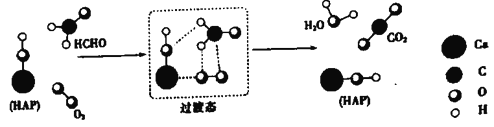
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=c(CO)c(H2O)/c(CO2)c(H2)。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应化学方程式为CO+H2O ![]() CO2+H2 B. 升高温度,逆反应速率减小
CO2+H2 B. 升高温度,逆反应速率减小
C. 恒温恒容下,增大压强,H2浓度一定减小 D. 该反应是焓变为正值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com