
| A. | BaCl2、H2SO4、MgCl2 | B. | CaCl2、HNO3、AgNO3 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、NaCl |
分析 由Na2CO3溶液$\stackrel{甲}{→}$白色沉淀$\stackrel{过量乙}{→}$沉淀溶解丙产生气体$\stackrel{丙}{→}$产生白色沉淀可知,加甲生成的白色沉淀与酸反应生成气体和沉淀,则甲中含钡离子或钙离子,乙为酸,后来沉淀为硫酸钡或硝酸银,以此来解答.
解答 解:A.由Na2CO3溶液$\stackrel{BaCl_{2}}{→}$BaCO3$\stackrel{过量H_{2}SO_{4}}{→}$沉淀溶解并产生气体,但不符合$\stackrel{丙}{→}$产生白色沉淀,故A不选;
B.由Na2CO3溶液$\stackrel{CaCl_{2}}{→}$CaCO3$\stackrel{过量HNO_{3}}{→}$沉淀溶解并产生气体$\stackrel{AgNO_{3}}{→}$产生AgCl白色沉淀,故B选;
C.由Na2CO3溶液$\stackrel{CaCl_{2}}{→}$CaCO3$\stackrel{过量HNO_{3}}{→}$沉淀溶解并产生气体$\stackrel{NaCl}{→}$不反应,故C不选;
D.由Na2CO3溶液$\stackrel{BaCl_{2}}{→}$BaCO3$\stackrel{HCl}{→}$沉淀溶解并产生气体$\stackrel{NaCl}{→}$不反应,故D不选.
故选B.
点评 本题考查无机物的推断,为高频考点,综合考查元素化合物知识,把握转化中沉淀溶解时乙为酸,而后来沉淀应为硫酸钡或氯化银为解答的关键,侧重分析能力及知识综合应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | ||
| A | 25 | 5 | 0.1 | 20 | 0.1 |
| B | 25 | 5 | 0.2 | 10 | 0.2 |
| C | 35 | 5 | 0.1 | 20 | 0.1 |
| D | 35 | 5 | 0.2 | 10 | 0.2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A.运石油的油罐车上应贴  标志,并由专人押运 标志,并由专人押运 | |
| B. | 不慎将酒精洒到桌面上引起着火,可用水扑灭 | |
| C. | 氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用硼酸稀溶液冲洗 | |
| D. | 右图装置可分离CH3COOC2H5和碳酸钠饱和溶液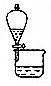 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑤ | C. | ①④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色. |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中通入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和④ | B. | ②和③ | C. | ②③④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在H2SO4溶液中滴入Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| D. | 醋酸溶解鸡蛋壳:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com