
| A. | ⅠA元素的电负性从上到下逐渐增大,而ⅦA元素的电负性从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
分析 A.IA族元素从上到下金属性增强,ⅦA族元素从上到下非金属性减弱,非金属性越强,电负性越大,金属性越强,电负性越小;
B.金属的电负性一般小于1.8,非金属的电负性一般大于1.8;
C.氢原子中只有一个电子,但不是只有一个轨道;
D.NaH中的H元素最低为-1,ⅦA族中元素的最低化合价为-1价.
解答 解:A.ⅠA元素从上到下,非金属性减弱,金属性增强,所以电负性从上到下逐渐减小;ⅦA族元素从上到下非金属性减弱,Ⅶ元素的电负性从上到下逐渐减小,故A正确;
B.金属的电负性一般小于1.8,非金属的电负性一般大于1.8,所以电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度,故B正确;
C.氢原子中有一个电子,但轨道是人们规定的,只是空轨道而已,氢原子不只有一个轨道,故C错误;
D.NaH中的H元素最低为-1,则H可以放在放在ⅦA族中,故D正确;
故选C.
点评 本题考查元素电离能、电负性变化规律,为高频考点,明确电离能与失电子难易程度、电负性与得电子强弱关系是解本题关键,侧重考查运用知识解答问题能力,熟练掌握元素周期律知识,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ICl中I显-1价 | |
| B. | HI是反应的中间产物 | |
| C. | 总反应速率的快慢主要由反应②决定 | |
| D. | 总反应的热化学方程式为H2(g)+2ICl(s)=I2(s)+2HCl(g)△H=-109kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.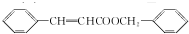 ,下列关于X的说法不正确的是bc(填字母).
,下列关于X的说法不正确的是bc(填字母). 或
或 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子个数比 | N(A):N(C)=2:1 | N(A):N(C)=1:1 | N(B):N(A)=1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子个数比 | N(D):N(C)=1:1 | N(E):N(F)=1:3 | N(B):N(F)=1:4 |
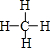 .
.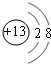 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
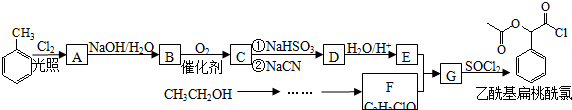
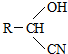 ,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′
,RCN$\stackrel{H_{2}O/H+}{→}$RCOOH,RCOOH$\stackrel{SOCl_{2}}{→}$RCOCl$\stackrel{R′OH}{→}$RCOOR′ .
. .
. .
.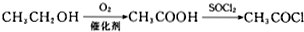 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物中一定含有甲醛 | |
| B. | 混合物中醛和醇的质量比可能为5:3 | |
| C. | 混合物中一定含有乙醛 | |
| D. | 混合物中一定含有乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com