
【题目】如图是由4个碳原子结合成的6种有机物(氢原子没有画出)
![]()
(1) 写出有机物(a)的系统命名法的名称___________________。
(2) 有机物(a)有一种同分异构体,试写出其结构简式__________________。
(3) 上述有机物中与(c)互为同分异构体的是________(填代号)。
(4) 任写一种与(e)互为同系物的有机物的结构简式____________。
(5) 上述有机物中不能与溴反应并使其褪色的有________(填代号)。
(6) (a)(b)(c)(d)四种物质中,4个碳原子一定处于同一平面的有________(填代号)。
【答案】 2甲基丙烷 CH3CH2CH2CH3 b、f CH≡CH(合理即可) (a)、(f) (b)、(c)
【解析】(1)根据碳四价可写出(a)的结构为CH(CH3)3,名称为2甲基丙烷。
(2) CH(CH3)3的一种同分异构体为CH3CH2CH2CH3。
(3)b、c、f的分子式均为C4H8,结构不同,故互为同分异构体,因此与(c)互为同分异构体的是b、f。
(4) e的结构简式为为CH≡CCH2CH3,为炔烃,同系物有多种,如CH≡CH或CH3CH≡CH等。
(5) (a)是烷烃、(f)是环烷烃,均为碳碳单键,不能与溴水反应并使其褪色。
(6) 乙烯分子中6个原子处于同一个平面,b、c的结构与乙烯的结构相似,相当于乙烯分子中的氢原子被甲基取代,故b、c分子中的四个碳原子一定处于同一个平面。


科目:高中化学 来源: 题型:
【题目】Ⅰ、按要求填空:
(1)32 g CH4,其摩尔质量为_______,约含有____摩电子,在标准状况下所占的体积约为____L。
(2)等体积等物质的量浓度的Ca(OH)2溶液与NaHCO3溶液混合,离子方程式为:______。
(3)H++HCO3-=H2O+CO2↑对应的一个化学方程式________________________。
(4)制备氢氧化铁胶体的离子方程式________________。
Ⅱ、现有以下物质:
①NaCl固体 ②液态SO3 ③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔化的KNO3 ⑨盐酸。请回答下列问题(填序号)。
(1)以上物质中能导电的是__________________。
(2)以上物质属于电解质的是_________________。
(3)以上物质中属于非电解质的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在b L Al2(SO4)3和(NH4)2SO4的混合溶液中加入a mol BaCl2,恰好使溶液中的SO42-﹣离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为
A. (2a-c)/b B. (2a-c)/2b C. (2a-c)/3b D. (2a-c)/6b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子核磁共振谱是研究有机化合物结构的有力手段之一。结构中的等效氢原子核磁共振谱中都给出了相应的峰值(信号),谱中峰的强度与结构中的H原子数成正比。试回答:
(1)结构简式为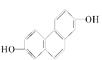 的有机化合物,在核磁共振谱中观察峰给出的强度之比为___________。
的有机化合物,在核磁共振谱中观察峰给出的强度之比为___________。
(2)实践中可根据核共振谱上观察到H原子给出的峰值情况,确定有机化合物的结构。分子式为C3H6O2的链状有机化合物核磁共振谱上峰给出的稳定强度仅有四种,它们分别是①3∶3,②3∶2∶1,③3∶1∶1∶1,④1∶2∶2∶1。
请分别推断出其对应的结构简式:
①________________________; ② ___________________________;
③________________________; ④ ___________________________。
(3)测得CH3CH2CH2CH3化合物核磁共振谱上可观察到两种峰,而CH3CH=CHCH3的核磁共振谱有4种峰,结合其空间结构 ,解释产生4个峰的原因:_______________。
,解释产生4个峰的原因:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1molSiO2含有4mol Si—O。有关键能数据如表,晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)=SiO2(s);ΔH=-989.2kJ·mol-1,则表中x的值为
化学键 | Si—O | O=O | Si—Si |
键能/kJ·mol-1 | x | 498.8 | 176 |
A. 460 B. 920 C. 1165.2 D. 423.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题
(1)向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体的离子方程式为_______________________。
(2)Ca(OH)2的电离方程式为_______________。
(3)现有下列物质:①干冰②NaHCO3晶体③氨水④纯醋酸⑤FeCl3溶液⑥铜⑦蔗糖⑧熔化的NaCl,其中属于非电解质的是___________(填序号,下同),属于强电解质的有____________,属于弱电解质的有________________,能导电的物质有________________。
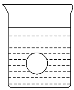
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀H2SO4至恰好完全反应。在此实验过程中,此实验中观察到的现象有___________________________________________。
(5)下列说法正确的是_________________。
①碱性氧化物一定是金属氧化物;
②酸性氧化物一定是非金属氧化物;
③乳浊液静止后分层;
④Mg2+、SO42-、Fe3+、X四种离子以物质的量之比1:2:1:1大量共存于同一水溶液中,X可能是NO3﹣;
⑤碳酸钙是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D,原子序数依次增大,A的基态原子的L层电子是K层电子的两倍;B的价电子层中的未成对电子有3个;C与B同族;D的最高价含氧酸为酸性最强的无机含氧酸。请回答下列问题:
(1)C的基态原子的电子排布式为___________;D的最高价含氧酸酸性比其低两价的含氧酸酸性强的原因是_____________________________________________。
(2)杂化轨道分为等性和不等性杂化,不等性杂化时在杂化轨道中有不参加成键的孤电子对的存在。A、B、C都分别能与D形成中心原子杂化方式均为___________的共价化合物X、Y、Z。其中,属于不等性杂化的是___________ (写化学式)。
(3)比较Y、Z的熔沸点Y______Z(填“>”、“<”或“=”),并解释理由_____________________。
(4)D元素能与Cu形成棕黄色固体,加水溶解并稀释过程中,溶液颜色由绿色逐渐转化为蓝色,显绿色离子是_________________,显蓝色离子中的配位原子________________。
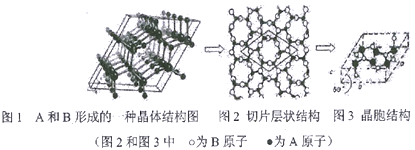
(5)A和B能形成多种结构的晶体。其中一种类似石墨的结构,其结构如下图所示(图1为晶体结构,图2为切片层状结构),其化学式为__________。实验测得此晶体结构属于六方晶系,晶胞结构见图3。已知图示原子都包含在晶胞内,晶胞参数a=0.64nm,c=0.24nm。其晶体密度为__________g/cm3(已知:2=1.414,后=1.732,结果精确到小数点后第2位。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。已知碱石灰的成分是氢氧化钠和氧化钙的混合物;炭与水蒸气在高温条件下发生以下反应:C + H2O(g)![]() CO + H2。回答下列问题:
CO + H2。回答下列问题:
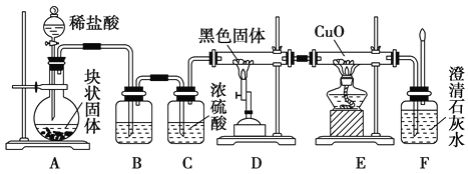
(1)写出装置A中发生反应的离子方程式____________________。
(2)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:____________。
(3)装置D中黑色固体为___________ (填名称)。
(4)按照如图装置进行实验时,首先进行的操作是___________________________________ 。
(5)根据实验中的____________________________现象,可证明CO具有还原性。
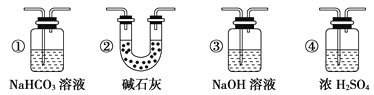
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置____与____之间连接下图中的____________________装置(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com