
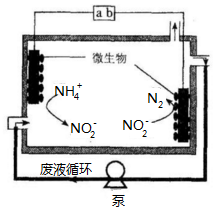
 微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )
微生物电解法可用于处理废水.其工作原理如图所示,下列说法正确的是( )| A. | a为电源的负极 | |
| B. | 右侧电极反应式为:2NO2-+6e-+4 H+=N2↑+4OH- | |
| C. | 电池工作一段时间后,溶液中NO2-的浓度不变 | |
| D. | 每通过3mol电子,最多处理0.5mol NH4+ |
分析 A.根据图知,连接a的电极上 NH4+失电子生成NO2-,发生氧化反应,为阳极,连接b的电极上亚硝酸根离子得电子发生还原反应,为阴极;
B.右侧电极上生成氮气和水;
C.其电池反应式为NH4++NO2-=N2↑+2H2O;
D.左侧电极反应式为NH4+-6e-+2H2O=NO2-+8H+,根据铵根离子和转移电子之间的关系式计算.
解答 解:A.根据图知,连接a的电极上 NH4+失电子生成NO2-,发生氧化反应,为阳极,连接b的电极上亚硝酸根离子得电子发生还原反应,为阴极,则连接阴极的b为负极、连接阳极的a为正极,故A错误;
B.右侧电极上生成氮气和水,左侧电极反应式为NH4+-6e-+2H2O=NO2-+8H+、右侧电极反应式为2NO2-+6e-+8H+=N2↑+4H2O,故B错误;
C.其电池反应式为NH4++NO2-=N2↑+2H2O,所以电池工作一段时间后,溶液中NO2-的浓度减小,故C错误;
D.左侧电极反应式为NH4+-6e-+2H2O=NO2-+8H+,根据方程式知,消耗1mol铵根离子转移6mol电子,所以每通过3mol电子,最多处理0.5mol NH4+,故D正确;
故选D.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断能力,明确得失电子与电极的关系是解本题关键,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用KIO3 氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向Ca(ClO)2溶液中通入过量CO2制次氯酸:ClO-+H2O+CO2═HClO+HCO3- | |
| C. | 向酸性KMnO 4溶液中滴入H 2O2:2MnO 4-+6H++3H2O2═2Mn 2++4O2↑+6H2O | |
| D. | 用Cl2与石灰乳反应制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、Cl- | B. | K+、MnO4-、Br-、Cl- | ||
| C. | Na+、Cl-、NO3-、SO42- | D. | Al3+、NH4+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
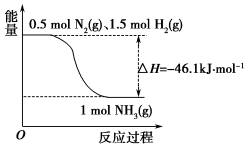 氨在工农业生产中应用广泛.
氨在工农业生产中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家为实现“低碳”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:
科学家为实现“低碳”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单气态氢化物的热稳定性:Y<W | |
| B. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| C. | Z和W的简单离子具有相同的电子层结构 | |
| D. | 化合物ZX2中既含有离子键,又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com