
【题目】A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示(部分产物略去)。

I.若A是能使湿润红色石蕊试纸变蓝的气体;C、D均为空气的主要成分;E是一种常见无色无味的有毒气体,B、E均为汽车尾气成分。
(1)写出反应①的化学方程式____________。
(2)写出B和E在催化剂条件下生成C的化学方程式______________。
II.若A是淡黄色化合物;常温下D是无色气体;C中含有的阴、阳离子均为10电子粒子;E为澄清石灰水。
(1)写出反应②的化学方程式_____________。
(2)将一定量的气体D通入2L C的溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。

①O点溶液中所含溶质的化学式为_______,横坐标3-5段发生的离子方程式为_____。
②标况下,通入气体D的体积为______L,C溶液的物质的量浓度为_______mol/L。
【答案】4NH3+5O2![]() 4NO+6H2O 2NO+2CO
4NO+6H2O 2NO+2CO![]() N2+2CO2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH NaOH、Na2CO3 HCO3-+H+=CO2↑+H2O 44.8 2.5
N2+2CO2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH NaOH、Na2CO3 HCO3-+H+=CO2↑+H2O 44.8 2.5
【解析】
I.若A是能使湿润的红色石蕊试纸变蓝的气体,则A是NH3,C、D均为空气的主要成分,且A和D能反应,则D是O2,C是N2,反应①为氨的催化氧化,则B是NO,E是一种有毒气体,NO和有毒气体反应生成氮气,说明E具有还原性,该气体为CO;
II.若A是淡黄色固体化合物,A为Na2O2,常温下D是无色气体,D是CO2,C分子中含有的阴、阳离子均为10电子粒子,C为NaOH,过氧化钠和二氧化碳反应生成B,B为Na2CO3,B和E反应生成氢氧化钠;
(2)①分析图象知,加入盐酸时,开始没有气体产生,加到一定量时才产生气体,根据Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl= NaCl+CO2↑+H2O,可知O点溶液中含有氢氧化钠和碳酸钠,a点开始产生气体,说明a点溶质为碳酸氢钠和氯化钠,根据溶质的性质分析解答;
②根据碳原子守恒计算二氧化碳的物质的量,根据钠原子守恒计算氢氧化钠的物质的量浓度。
I.根据上述分析可知:A是NH3,B是NO,C是N2,D是O2,E为CO。
(1)反应①是NH3催化氧化产生NO,根据电子守恒、原子守恒,可得该反应方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)在催化剂条件下,一氧化氮和一氧化碳反应生成氮气和二氧化碳,反应方程式为:2NO+2CO![]() N2+2CO2;
N2+2CO2;
II.根据上述推断可知:A为Na2O2,B为Na2CO3,C为NaOH,D是CO2,E为澄清石灰水。
(1) B为Na2CO3,C为NaOH,Na2CO3可以与澄清石灰水发生复分解反应产生NaOH和碳酸钙,反应的方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(2)①分析图象知,加入盐酸时,开始没有气体产生,加到一定量时才产生气体,根据Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,可知O点溶液中含有氢氧化钠和碳酸钠,化学式为NaOH、Na2CO3;a点开始产生气体,说明a点溶质为碳酸氢钠和氯化钠,横坐标在盐酸的体积为3-5段发生的反应是NaHCO3+HCl=NaCl+CO2↑+H2O,其离子方程式为HCO3-+H+=CO2↑+H2O;
②从a点开始,碳酸氢钠与盐酸反应,消耗盐酸的物质的量为2mol,根据NaHCO3+HCl= NaCl+CO2↑+H2O可知:碳酸氢钠和盐酸反应的物质的量之比为1:1,所以n(NaHCO3)为2mol,根据碳原子守恒,得n(NaHCO3)=n(CO2)=2mol,因此标况下,CO2的体积V(CO2)= n(CO2)·Vm=2mol×22.4L/mol=44.8L;
根据图象可知:溶液完全消耗的盐酸的物质的量是5mol,此时溶液中的溶质变为NaCl,根据氯元素、钠元素守恒得n(HCl)=n(NaCl)=n(NaOH)=5mol,所以c(NaOH)=![]() =2.5mol/L。
=2.5mol/L。


科目:高中化学 来源: 题型:
【题目】结构化学从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质。
(1)下列说法正确的是 ______(填字母)。
A、元素电离能由大到小的顺序:O>N>C
B、一个尿素(CO(NH2)2)分子中含1个π键和7个σ键
C、氯化钠和氯化铯晶体具有相同的晶胞
(2)根据等电子体原理,羰基硫(OCS)分子的电子式应为______。光气(COCl2)分子内各原子最外层都满足8电子稳定结构,则光气分子的空间构型为____(用文字描述)。
(3)Cu2+基态的电子排布式为______。将硫酸铜溶液蒸发浓缩后降温结晶,析出蓝色晶体,取25.0g晶体置于坩埚中在一定温度下灼烧,测得剩余固体质量始终保持为23.2g,进一步升高灼烧温度,固体变为白色且质量为16.0g,已知该晶体属于配合物(配合物的内界结构比较稳定),推测其合理的化学式可以表示为______。
(4)通常情况下,溶液中的Fe3+比Fe2+稳定,理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两根金属棒插入Z溶液中构成如图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( )

选项 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Cu | Zn | 稀硫酸 |
C | Cu | Ag | 硫酸铜溶液 |
D | Ag | Zn | 硫酸铜溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol/L H2SO4的含义是
A.1L 水中含有1mol H2SO4 B.1L 溶液中含有1mol H+
C.1L H2SO4溶液中含98g H2SO4 D.将98g H2SO4溶于1L水配成溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如下图所示(已知A、B、C均为气体)。
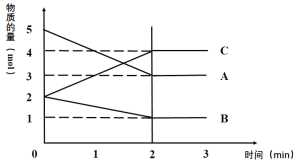
(1)该反应的化学方程式为__________________。
(2)反应开始至2分钟时,B的平均反应速率为______________。
(3)能说明该反应已达到平衡状态的是_________。
A.υ(A)=2υ(B) B.容器内气体密度不变 C.υ逆(A)=υ正(C)
D.各组分的物质的量相等 E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为________。
II.已知甲烷燃烧的化学反应方程式为CH4+2O2![]() CO2+2H2O,若以4mol/L 500mL KOH(aq)为电解质溶液,将其设计为原电池,则
CO2+2H2O,若以4mol/L 500mL KOH(aq)为电解质溶液,将其设计为原电池,则
(1)其正极电极方程式为___________。
(2)至某时刻溶液中c(CO32-)=1mol/L,则导线上通过的电子的物质的量为_____,此时消耗标准状况下CH4体积_____ L 。(假设化学能全部转化为电能;溶液体积保持不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在元素周期表中的位置如图,其中Z的原子半径最小。下列说法正确的是( )

A. M元素一定为金属元素
B. X元素的最简单气态氢化物的热稳定性比Z的强
C. 若Y元素存在最高价含氧酸,其酸性比X元素的最高价含氧酸弱
D. Z元素与氢元素能形成原子个数比为1∶1的共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Li、Na、K、Rb、Cs的叙述均正确的一组是( )
①金属性最强的是铯 ②它们的氧化物都只有M20和M202两种形式
③在自然界中均以化合态形式存在 ④密度按Li→Cs 顺序依次递增
⑤离子半径:Rb+>K+>Na+
A.①②③B.③④⑤C.②④⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为短周期内原子序数依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是

A. 沸点N>M
B. A、C、D的常见氧化物相互之间一定能反应
C. 简单离子半径:D2->B2->C+>A+
D. C与其他元素均能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①![]() 和
和![]() ②红磷和白磷 ③
②红磷和白磷 ③![]() 和
和![]() ④
④![]() 和
和![]() ⑤
⑤![]() 和
和![]() ⑥
⑥ 和
和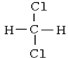
(1)属于同素异形体的是________(2)互为同位素的是________
(3)互为同分异构体的是________(4)属于同系物的是________
(5)属于同种物质的是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com