
【题目】高分子树脂M具有较好的吸水性,其合成路线如下:

已知: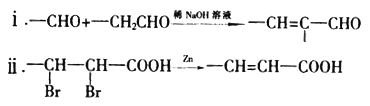
(1)C的名称为______________,D中的官能团为__________________,结构简式为_____________。
(2)由A生成B的化学方程式为___________________。
(3)上述合成路线中,D→E转化在合成M中的作用为___________________________。
(4)下列关于F的叙述正确的是___________。
A.能与NaHCO3反应生成CO2 B.能发生水解反应和消去反应
C.能聚合成高分子化合物 D. 1 mol G最多消耗2 mol NaOH
(5)H是G的同系物,且与G相差一个碳原子,则同时满足下列条件的H的同分异构体共有______种(不考虑立体异构)。
①与G具有相同的官能团 ②苯环上只有两个取代基
(6)根据上述合成路线和信息,以苯乙醛为原料(其他无机试剂任选),设计制备 的合成路线_________________________。
的合成路线_________________________。
【答案】 苯乙醛 碳碳双键、醛基 
 保护碳碳双键,防止其被氧化 AB 18
保护碳碳双键,防止其被氧化 AB 18 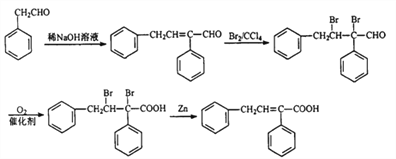
【解析】![]() 与Cl2在光照条件下生成的A为
与Cl2在光照条件下生成的A为![]() ,再在NaOH的水溶液中加热水解生成的B为
,再在NaOH的水溶液中加热水解生成的B为![]() ,再催化氧化得到的C为
,再催化氧化得到的C为![]() ,C和HCHO在NaOH的稀溶液中反应生成的D为
,C和HCHO在NaOH的稀溶液中反应生成的D为![]() ,D再与Br2发生加成反应生成的E为
,D再与Br2发生加成反应生成的E为![]() ,E催化氧化后得到的F为
,E催化氧化后得到的F为![]() ,F在Zn粉的作用下发生消去反应生成的G为
,F在Zn粉的作用下发生消去反应生成的G为![]() ,G再发生加聚反应得到M为
,G再发生加聚反应得到M为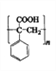 ;
;
(1)![]() 的名称为苯乙醛,D的结构简式为
的名称为苯乙醛,D的结构简式为![]() ,含有的官能团为碳碳双键、醛基;M的结构简式为
,含有的官能团为碳碳双键、醛基;M的结构简式为 。
。
(2)由![]() 生成
生成![]() 的化学方程式为
的化学方程式为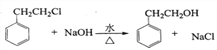 ;
;
(3)上述合成路线中,D→E转化在合成M中的作用为保护碳碳双键,防止其被氧化;
(4)A.![]() 中有羧基,能与NaHCO3反应生成CO2,故A正确;B.
中有羧基,能与NaHCO3反应生成CO2,故A正确;B.![]() 能发生卤代烃的水解反应和消去反应,故B正确;C.
能发生卤代烃的水解反应和消去反应,故B正确;C.![]() 中不存在碳碳双键,不能聚合成高分子化合物,故C错误;D. 1 mol
中不存在碳碳双键,不能聚合成高分子化合物,故C错误;D. 1 mol![]() 最多消耗1 mol NaOH,故D错误,答案为AB。
最多消耗1 mol NaOH,故D错误,答案为AB。
(5)H是![]() 的同系物,且与之相差一个碳原子,应该是多一个碳原子,则同时满足①与G具有相同的官能团;②苯环上只有两个取代基,可以是甲基与—CH=CHCOOH或—C(COOH)=CH2,可以是—CH=CH2与—CH2COOH,也可以是—CH=CHCH3或—CH2CH=CH2与—COOH,每种情况有邻、间、对位三种位置,故共有15种同分异构体。
的同系物,且与之相差一个碳原子,应该是多一个碳原子,则同时满足①与G具有相同的官能团;②苯环上只有两个取代基,可以是甲基与—CH=CHCOOH或—C(COOH)=CH2,可以是—CH=CH2与—CH2COOH,也可以是—CH=CHCH3或—CH2CH=CH2与—COOH,每种情况有邻、间、对位三种位置,故共有15种同分异构体。
(6)以苯乙醛为原料合成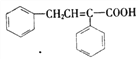 的合路线为
的合路线为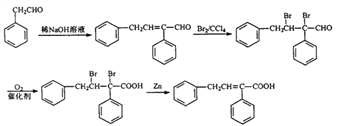 。
。
点晴:本题题干给出了较多的信息,学生需要将题目给信息与已有知识进行重组并综合运用是解答本题的关键,需要学生具备准确、快速获取新信息的能力和接受、吸收、整合化学信息的能力,采用正推和逆推相结合的方法,逐步分析有机合成路线,可推出各有机物的结构简式,然后分析官能团推断各步反应及反应类型。本题需要学生根据![]() 的结构特点分析合成的原料,再结合正推与逆推相结合进行推断,充分利用反应过程C原子数目,对学生的逻辑推理有较高的要求。难点是同分异构体判断,注意题给条件,结合官能团的性质分析解答。
的结构特点分析合成的原料,再结合正推与逆推相结合进行推断,充分利用反应过程C原子数目,对学生的逻辑推理有较高的要求。难点是同分异构体判断,注意题给条件,结合官能团的性质分析解答。


科目:高中化学 来源: 题型:
【题目】下列有关金属及其合金的说法不正确的是( )
A.目前我国流通的硬币是由合金材料制造的
B.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
C.出土的古代铜制品表面覆盖着铜绿其主要成分为 CuO
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.6kJ/mol.实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=﹣92.6kJ/mol.实验测得起始、平衡时的有关数据如下表:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15kJ
D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质可用分液漏斗分离的正确组合是 ( )
①乙醇和乙酸 ②葡萄糖溶液和蔗糖溶液 ③苯和食盐水
④苯和苯酚 ⑤乙酸乙酯和乙醇 ⑥甲酸乙酯和饱和纯碱溶液
A. ③⑥ B. ①③④⑥ C. ①②④⑥ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲将蛋白质从水中析出而又不改变它的性质,应加入 ( )
A. (NH4)2SO4溶液 B. 75%的酒精溶液
C. CuSO4溶液 D. NaOH浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol/L氨水的电离度为1.32%,下列有关叙述不正确的是
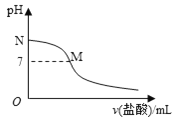
A.该滴定过程应该选择甲基橙作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
D.N点处的溶液中pH<13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列物质的用途及解释均正确的是
选项 | 用途 | 解释 |
A | 可用FeCl3溶液刻蚀铜制电路板 | Fe3+的氧化性强于Cu2+ |
B | 碳与石英反应可冶炼粗硅 | 碳的非金属性比硅强 |
C | 四氯化碳可用于灭火 | 四氯化碳的沸点高 |
D | 酸性KMnO4溶 液可漂白织物 | KMnO4有强氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质A经下列变化过程转化为D,其中C比B的相对分子质量多16,
![]()
已知D为强酸或者强碱,请回答下列问题:
(1)若常温下C为淡黄色固体,D的焰色为黄色,则工业制取D的反应方程式为:_______________;
(2)若A常温下是气体,C为红棕色气体。
①若A→B是工业制取硝酸的重要步骤之一,写出该步反应的化学方程式
为:_____________________________;
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的离子方程式
为:_________________________________________;
(3)若A为淡黄色固体,B是形成酸雨的罪魁祸首之一。
①D的化学式为:_________ ,
②酸雨放置在空气中一段时间其PH会变小后保持不变,请说明原因:
____________________________________(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com