
有机化合物的结构可用键线表示,如CH2=CHCH2Br可表示为 ,则有机物
,则有机物 的二氯代物有()
的二氯代物有()
A.2种 B.3种 C.4种 D.5种
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 电化学原理及其应用练习卷(解析版) 题型:选择题
某化学学习小组学习电化学后,设计了下面的实验装置图:

下列有关该装置图的说法中正确的是( )
A.合上电键后,盐桥中的阳离子向甲池移动
B.合上电键后,丙池为电镀银的电镀池
C.合上电键后一段时间,丙池中溶液的pH增大
D.合上电键后一段时间,当丙池中生成标准状况下560 mL气体时,丁池中理论上最多产生2.9 g固体
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质的量及其应用练习卷(解析版) 题型:选择题
下列叙述中正确的是( )
A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等
B.标准状况下,28 g CO和22.4 L SO3所含分子数相等
C.5.6 g铁粉与足量氯气充分反应,有0.2 mol电子转移
D.等物质的量的CH5+和NH2—所含电子数相等
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质的组成性质分类及化学用语练习卷(解析版) 题型:选择题
氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是( )

A.2Na2O2+2CO2=2Na2CO3+O2 B.2NaHCO3=Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 D.Cl2+2KBr=Br2+2KCl
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 有机化学基础练习卷(解析版) 题型:推断题
化合物A(分子式为C6H6O)是一种有机化工原料,在空气中易被氧化。A的有关转化反应如下(部分反应条件略去):
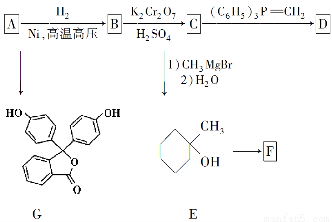

(1)写出A的结构简式:________。
(2)G是常用指示剂酚酞。写出G中含氧官能团的名称:________和________。
(3)某化合物是E的同分异构体,且分子中只有两种不同化学环境的氢。写出该化合物的结构简式:________(任写一种)。
(4)F和D互为同分异构体。写出反应E→F的化学方程式:________________________________。
(5)根据已有知识并结合相关信息,写出以A和HCHO为原料制备CHO的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
H2C=CH2 CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 有机化学基础练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.按系统命名法,化合物 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
C.苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段为 的高聚物,其单体是甲醛和苯酚
的高聚物,其单体是甲醛和苯酚
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 常见无机物及其应用练习卷(解析版) 题型:选择题
下列说法中正确的是( )
A.硅主要以单质、氧化物、硅酸盐的形式存在于自然界中
B.青铜是我国使用最早的合金,钢是用量最大、用途最广泛的合金
C.漂白粉、漂粉精可用来漂白棉、麻、纸张,不能用作游泳池及环境的消毒剂
D.合成纤维和光导纤维都是高分子化合物
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化工生产流程、无机物的判断练习卷(解析版) 题型:选择题
如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是( )

A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学基本理论练习卷(解析版) 题型:选择题
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO2为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO2为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为6?5.3
B.若反应开始时容器体积为2 L,则有v(SO3)=0.35 mol/(L·min)
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com