
| A. | 钙元素 | B. | 碘元素 | C. | 铁元素 | D. | 钠元素 |
科目:高中化学 来源: 题型:选择题

| A. | 步骤1为吸热反应,步骤2为放热反应 | |
| B. | E2>E3>E1 | |
| C. | 1mol C发生该反应时吸收的能量为E3-E1 | |
| D. | E2-E1<E2-E3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
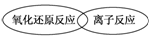 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
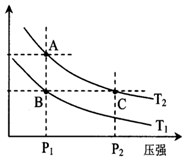 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=a kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=a kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
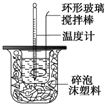
| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶电解质在水中存在沉淀溶解平衡,且是一种动态平衡 | |
| B. | Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和离子浓度无关 | |
| C. | 在一定温度下的BaSO4饱和溶液中加入少量BaCl2固体,BaSO4的Ksp减少 | |
| D. | 当阴、阳离子个数比相同时,难溶电解质的Ksp数值越大,溶解能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
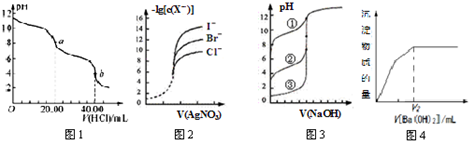
| A. | 图1是用0.l000 mol•L-1的盐酸滴定20.00 mL 0.l000mol•L-1Na2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+=CO2↑+H2O | |
| B. | 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- | |
| C. | 用0.1000 mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图3曲线确定①的酸性最强 | |
| D. | 图Ⅳ表示明矾中滴入Ba(OH)2溶液,图中的V2表示生成的氢氧化铝恰好溶解时加入Ba(OH)2溶液的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com