
 A、B、C、D、E、F、G为原子序数依次增大的前四周期元素.A、F原子的最外层电子数均等于其周期序数.F原子的电子层数是A的3倍; B原子核外电子分处3个不同能级.且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对.E与F同周期;G的原子序数等于A、C、D、F 四种元素原子序数之和.
A、B、C、D、E、F、G为原子序数依次增大的前四周期元素.A、F原子的最外层电子数均等于其周期序数.F原子的电子层数是A的3倍; B原子核外电子分处3个不同能级.且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对.E与F同周期;G的原子序数等于A、C、D、F 四种元素原子序数之和. ;回答E与F原子的第一电离能的大小关系怎样,原因是Mg原子3s能级为全满稳定结构,能量较低;
;回答E与F原子的第一电离能的大小关系怎样,原因是Mg原子3s能级为全满稳定结构,能量较低;分析 A、B、C、D、E、F、G为原子序数依次增大的前四周期元素,A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍,则A为H元素,F为Al元素;B原子核外电子分处3个不同能级且每个能级上的电子数相同,则B的核外电子排布为1s22s22p2,则B为碳元素;A与C形成的分子为三角锥形,且C的原子序数介于碳、铝之间,所以C为N元素;D原子p轨道上成对的电子总数等于未成对的电子总数,即p轨道上有4个电子,由于D的原子序数小于Al,所以D的核外电子排布为1s22s22p4,所以D为O元素;E原子核外每个原子轨道上的电子都已成对,E与Al同周期,且原子序数小于F,所以E为Mg元素;G的原子序数等于A、C、D、F 四种元素原子序数之和,则G的原子序数为1+7+8+13=29,故G为Cu,据此解答.
解答 解:A、B、C、D、E、F、G为原子序数依次增大的前四周期元素,A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍,则A为H元素,F为Al元素;B原子核外电子分处3个不同能级且每个能级上的电子数相同,则B的核外电子排布为1s22s22p2,则B为碳元素;A与C形成的分子为三角锥形,且C的原子序数介于碳、铝之间,所以C为N元素;D原子p轨道上成对的电子总数等于未成对的电子总数,即p轨道上有4个电子,由于D的原子序数小于Al,所以D的核外电子排布为1s22s22p4,所以D为O元素;E原子核外每个原子轨道上的电子都已成对,E与Al同周期,且原子序数小于F,所以E为Mg元素;G的原子序数等于A、C、D、F 四种元素原子序数之和,则G的原子序数为1+7+8+13=29,故G为Cu.
(1)B的核外电子排布为1s22s22p2,则核外电子排布图为 ,Mg原子3s能级为全满稳定结构,能量较低,第一电离能高于Al,
,Mg原子3s能级为全满稳定结构,能量较低,第一电离能高于Al,
故答案为: ;Mg的第一电离能高于Al;Mg原子3s能级为全满稳定结构,能量较低;
;Mg的第一电离能高于Al;Mg原子3s能级为全满稳定结构,能量较低;
(2)原子总数相等、价电子总数相等的微粒互为电子,与N3-互为等电子体的分子的化学式N2O、CO2,
故答案为:N2O、CO2;
(3)A与D形成的H2O2分子中O原子形成2个σ键、含有2对孤电子对,O原子采取sp3杂化,A与C形成的最简单分子为NH3,氨气分子与水分子之间形成氢键,且氨气分子与水分子均为极性分子,相似相溶,氨气易溶于水,
故答案为:sp3;氨气分子与水分子之间形成氢键,且氨气分子与水分子均为极性分子,相似相溶;
(4)Cu的晶体为面心立方最密堆积,晶体中原子按“ABCABCABC”的 方式堆积而成,
故答案为:ABCABCABC;面心立方最密堆积;
(5)Cu的晶体为面心立方最密堆积,以顶点原子研究,与之最近的Cu原子处于面心,配位数为$\frac{3×8}{2}$=12,面心立方最密堆积的空间利用率 为74%,
故答案为:12;74%;
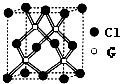
(6)晶胞中Cu原子数目为4、Cl原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故该氯化物的化学式为CuCl,两种微粒间最短距离为460.0pm,晶胞体对角线长度为4×460.0pm=4×460.0×10-10 cm,晶胞棱长为$\frac{\sqrt{3}}{3}$×4×460.0×10-10 cm,晶胞质量为$\frac{4×99.5}{6.02×1{0}^{23}}$g,则晶体密度为$\frac{4×99.5}{6.02×1{0}^{23}}$g÷($\frac{\sqrt{3}}{3}$×4×460.0×10-10 cm)3=$\frac{4×99.5}{(\frac{\sqrt{3}}{3}×4×460×1{0}^{-10})^{3}×6.02×1{0}^{23}}$g/cm3,
故答案为:$\frac{4×99.5}{(\frac{\sqrt{3}}{3}×4×460×1{0}^{-10})^{3}×6.02×1{0}^{23}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、等电子体、杂化方式判断、分子结构与性质、晶胞结构与计算,熟记中心常见晶胞结构,(6)中计算为难点,需要学生具备一定空间想象与数学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 为测定该消毒液的pH,用玻璃棒蘸取液体滴在pH试纸上与标准比色卡对照即可 | |
| B. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| D. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-═HClO+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Cl2与足量NaOH溶液反应,转移0.2 mol电子 | |
| B. | 1 mol Fe与1 mol Cl2反应转移3 mol电子 | |
| C. | 含有4 mol HCl的浓盐酸与足量MnO2反应,生成1 mol Cl2 | |
| D. | Cl2通入FeCl2溶液中,然后加KSCN溶液,溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中通入HCl气体 | D. | 向水中加食盐晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜是我国使用最早的合金,也是目前使用最广泛的合金 | |
| B. | 不管哪种铜合金都含有铜元素,所以它们的性质也和金属铜一样 | |
| C. | 铝合金的硬度比金属铝大 | |
| D. | 生铁的熔点高于纯铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3 | B. | KMnO4 | C. | MnO2 | D. | Ca(ClO)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3)(4) | B. | (2)(3)(4) | C. | (3)(4) | D. | (3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | n(A)(mol) | n(B)(mol) | n(C)(mol) |
| 0 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.4 |
| 第4min | 0.4 | 1.8 | 1.2 |
| 第6min | 0.4 | 1.8 | 1.2 |
| 第8min | 0.1 | 2.0 | 1.8 |
| 第9min | 0.05 | 1.9 | 0.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com