
| A. | 相同条件下NaHCO3比Na2CO3更 稳定 | |
| B. | 向等量的Na2CO3和NaHCO3固体中分别滴加同浓度的盐酸,后者产生气泡速率快 | |
| C. | 相同条件下NaHCO3比Na2CO3更易溶于水 | |
| D. | 经实验测定,Na2CO3溶液显碱性,说明Na2CO3属于碱 |
分析 A、加热NaHCO3不稳定易分解;
B、向Na2CO3和NaHCO3固体中分别滴加等浓度的盐酸,碳酸钠先与盐酸反应生成碳酸氢钠,碳酸氢钠与盐酸反应可生成二氧化碳气体;
C、相同条件下,碳酸钠的溶解度大;
D、碳酸钠是盐水解呈碱性.
解答 解:A、加热NaHCO3不稳定易分解,所以相同条件下Na2CO3比NaHCO3更稳定,故A错误;
B、向Na2CO3和NaHCO3固体中分别滴加等浓度的盐酸,碳酸钠先与盐酸反应生成碳酸氢钠,碳酸氢钠与盐酸反应可生成二氧化碳气体,后者反应速率快,故B正确;
C、相同条件下,碳酸钠的溶解度大,即常温下,NaHCO3比Na2CO3溶解度小,故C错误;
D、碳酸钠是盐水解呈碱性,而不是碱,故D错误;
故选B.
点评 本题考查碳酸钠和碳酸氢钠性质的比较,为高频考点,把握二者的溶解性、水解程度、与酸的反应为解答的关键,侧重分析能力的考查,综合性较强,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Zn为正极,Cu为负极,CuCl2溶液作电解质溶液 | |
| B. | Cu为正极,Zn为负极,稀H2SO4作电解质溶液 | |
| C. | Cu为正极,Zn为负极,CuSO4溶液作电解质溶液 | |
| D. | Fe为正极,Zn为负极,ZnSO4溶液作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
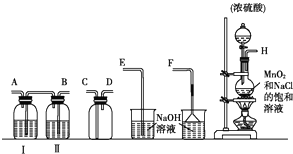
| 实验步骤 | 预期现象和结论 | |
| ① | 取少量上述漂白粉于试管中,加入适量1mol/L盐酸溶解后,再将产生的气体导入澄清石灰水中. | (1)若澄清石灰水未见浑浊,则假设1成立; (2)若澄清石灰水变浑浊,则假设2或3成立. |
| ② | 向步骤①反应后的试管中滴入1~2滴品红溶液,振荡(或另外取样操作) | 结合实验①中的(2), (1)若品红褪色,则假设3成立; (2)若品红不褪色,则假设2成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
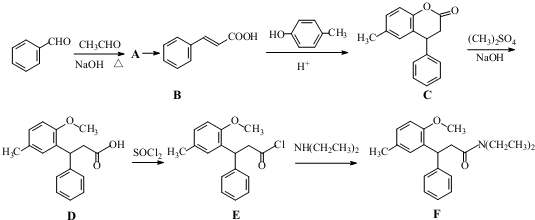
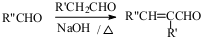
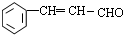 .
.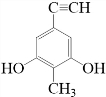 等.(任写一种)
等.(任写一种) )是一种高效麻醉剂,写出以
)是一种高效麻醉剂,写出以 、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图如下:
、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氧化反应与化合反应属于并列关系 | B. | 单质与化合物属于交叉关系 | ||
| C. | 化合物与氧化物属于包含关系 | D. | 纯净物与混合物属于包含关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 120mL | B. | 150mL | C. | 200mL | D. | 220mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
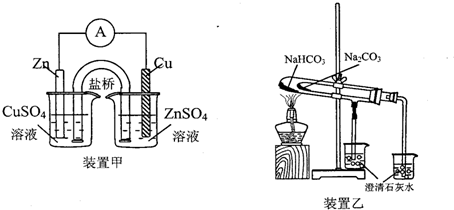
| A. | 用装置甲组装铜锌原电池 | |
| B. | 用装置乙比较NaHCO3和Na2CO3的热稳定性 | |
| C. | 配制1L0.010mol•L-1的纯碱溶液时用精度为0.1g的天平秤取1.06gNa2CO3 | |
| D. | 中和滴定时,锥形瓶用蒸馏水清洗2次后不烘干就盛放一定量的待测稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com