
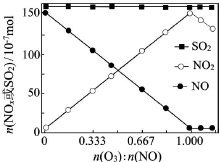
 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:分析 (1)①NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ.mol-1
②NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-58.2kJ.mol-1
根据盖斯定律,2×②+①可得:3NO(g)+O3(g)=3NO2(g),焓变进行相应的计算;
(2)①臭氧具有强氧化性,能氧化生成的NO2;
②增加n(O3),O3氧化SO2的反应几乎不受影响,说明浓度对反应速率影响较小,可能是其反应速率较慢;
(3)溶液pH约为8,说明溶液呈碱性,SO32-将NO2转化为NO2-,同时SO32-被氧化生成SO42-,根据反应物和生成物书写离子方程式;
(4)CaSO3水悬浮液中加入Na2SO4溶液,发生反应CaSO3+SO42-=CaSO4+SO32-,溶液中c(Ca2+)=$\frac{{K}_{sp}(CaS{O}_{3})}{c(S{{O}_{3}}^{2-})}$=$\frac{{K}_{sp}(CaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$;根据CaSO3+SO42-=CaSO4+SO32-知,加入硫酸钠导致亚硫酸根离子浓度增大,浓度越大反应速率越大.
解答 解:(1)①NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ.mol-1
②NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-58.2kJ.mol-1
根据盖斯定律,2×②+①可得:3NO(g)+O3(g)=3NO2(g),所以△H=2×(-58.2kJ.mol-1)+(-200.9kJ.mol-1)=-317.3kJ/mol,
故答案为:-317.3;
(2)①当n(O3):n(NO)>1时,臭氧过量,臭氧具有强氧化性,能将反应后NO2氧化为更高价氮氧化物,导致二氧化氮减少,
故答案为:O3将NO2氧化为更高价态氮氧化物;
②增加n(O3),O3氧化SO2的反应几乎不受影响,说明浓度对反应速率影响较小,可能是SO2与O3的反应速率慢,
故答案为:SO2与O3的反应速率慢;
(3)溶液pH约为8,说明溶液呈碱性,SO32-将NO2转化为NO2-,同时SO32-被氧化生成SO42-,根据反应物和生成物书写离子方程式为SO32-+2NO2+2OH-=SO42-+2NO2-+H2O,
故答案为:SO32-+2NO2+2OH-=SO42-+2NO2-+H2O;
(4)CaSO3水悬浮液中加入Na2SO4溶液,发生反应CaSO3+SO42-=CaSO4+SO32-,溶液中c(Ca2+)=$\frac{{K}_{sp}(CaS{O}_{3})}{c(S{{O}_{3}}^{2-})}$=$\frac{{K}_{sp}(CaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$,所以c(SO32-)=$\frac{{K}_{sp}(CaS{O}_{3})}{{K}_{sp}(CaS{O}_{4})}×c(S{{O}_{4}}^{2-})$;
根据CaSO3+SO42-=CaSO4+SO32-知,加入硫酸钠导致c(SO32-)增大,浓度越大反应速率越大,所以加快反应速率,提高NO2的吸收速率,
故答案为:$\frac{{K}_{sp}(CaS{O}_{3})}{{K}_{sp}(CaS{O}_{4})}×c(S{{O}_{4}}^{2-})$;CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率.
点评 本题考查了溶度积常数计算、反应速率影响因素、氧化还原反应离子方程式的书写、盖斯定律等知识点,综合性较强,侧重考查学生分析计算能力,难点是(4)题计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | “地沟油”禁止食用,但可以用来制皂 | |
| B. | 安全、合理的使用核能有利于降低碳排放 | |
| C. | 采用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| D. | 吸烟不会造成室内PM 2.5污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液的pH=7,则该溶液为中性溶液 | |
| B. | 一定温度下,向AgCl饱和溶液中加入少量NaCl固体,Ksp(AgCl)减小 | |
| C. | 常温下,反应X(s)+Y(l)═2Z(g)不能自发,则该反应的△H>0 | |
| D. | 常温下,0.01mol/L的NaOH溶液中由水电离的c(H+)=1.0×10-2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
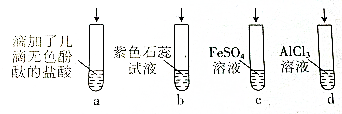
| A. | 若滴加过量的浓氨水,试管a中溶液由无色变红色 | |
| B. | 试管b中溶液由紫色变为蓝色 | |
| C. | 试管c中先有白色沉淀,后变为灰绿色,然后变为红褐色 | |
| D. | 试管d中先有白色沉淀,后白色沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
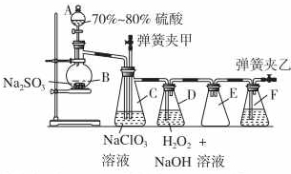 装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)
装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能够发生有效碰撞的分子叫做活化分子,活化分子所多出的那部分能量称作活化能 | |
| B. | 对于某一反应aA+bB=cC+dD,△H单位中的mol-1是指每摩尔(aA+bB=cC+dD)反应 | |
| C. | 研究有机物的组成、结构、性质、制备方法与应用的科学叫有机化学 | |
| D. | 甲烷分子具有正四面体结构的原因是碳原子的2S轨道与2P轨道发生SP杂化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com