
| A. | 78g过氧化钠晶体中,含3NA个离子 | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
分析 A、求出过氧化钠的物质的量,然后根据过氧化钠由2个钠离子和1个过氧根构成来分析;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、根据反应后氧元素的价态来分析;
D、氧气和臭氧均由氧原子构成.
解答 解:A、78g过氧化钠的物质的量为1mol,而过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含3mol离子即3NA个,故A正确;
B、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L氦气的物质的量小于1mol,则含有的氦原子小于NA个,故B错误;
C、由于反应后氧元素的价态可能为-1价或-2价,故当1mol氧气做氧化剂被还原后转移的电子可能为2NA个,也可能为4NA个,故C错误;
D、氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量为1mol,个数为NA个,故D正确.
故选AD.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| 陈述Ⅰ | 陈述Ⅱ | |
| A | BaSO4难溶于水 | SO2气体通入Ba(NO3)2溶液中沉淀 |
| B | 非金属性:Cl>S | 酸性:HClO3>H2SO4 |
| C | 常温下,NaHCO3的溶解度比Na2CO3小 | 向饱和Na2CO3溶液中通入CO2产生沉淀 |
| D | 常温下,SO2与氢硫酸和NaOH溶液均可反应 | SO2是两性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2- | B. | S | C. | SO42- | D. | SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
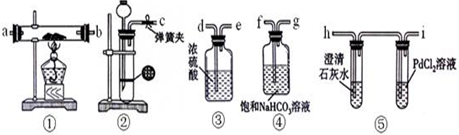
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
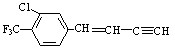 分子的下列叙述中,错误的是( )
分子的下列叙述中,错误的是( )| A. | 该物质使酸性高锰酸钾溶液褪色 | |
| B. | 一分子该物质能与6分子H2加成 | |
| C. | 最多有18个原子可能处在同一平面上 | |
| D. | 分子式为C11H6ClF3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO放入稀HCl中 | |
| B. | CuCl2的混合溶液中加入过量的铁粉 | |
| C. | Fe在氯气中燃烧后的产物 | |
| D. | 过量Fe粉放入FeCl3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
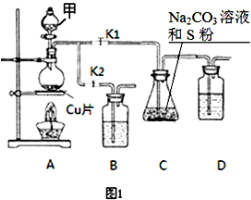 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.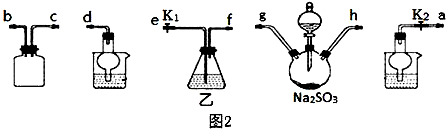
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com