
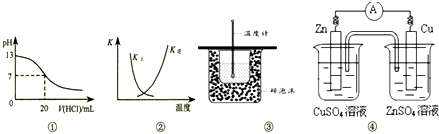
| A、图①表示25℃时,用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| B、图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 |
| C、图③装置用于测定中和热 |
| D、图④装置可以构成锌、铜、硫酸铜溶液原电池 |


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
| ||
| ||
| A、根据上述过程,每生成1molKMnO4,共转移6mol电子 | ||||
B、第二步电解时,阳极电极反应式为2MnO
| ||||
C、第二步电解的离子方程式为:2H2O
| ||||
| D、第二步电解时阴极周围pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、改变条件,反应物的转化率增大,平衡常数也一定增大 | ||||||
| B、反应2NO2(g)═N2O4(g)△H<0,升高温度该反应平衡常数增大 | ||||||
| C、对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等 | ||||||
D、CO2+H2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、催化剂能使不起反应的物质发生反应 |
| B、在化学反应前后催化剂性质和质量都发生改变 |
| C、催化剂能改变化学反应速率 |
| D、在化学反应过程中,一定不参与化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.265mol/L |
| B、0.525mol/L |
| C、0.21mol/L |
| D、0.42mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com