
【题目】氨浸菱锌矿制备活性氧化锌,成本低,选择性好,其工艺流程如下:
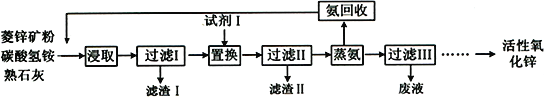
(1)滤渣Ⅰ主要成分的化学式为__________。
(2)浸取液中含少量Pb2+、Cu2+等重金属离子,可加入试剂Ⅰ除去,试剂Ⅰ为______________,但在实际操作过程中实际加入量远高于理论量,可能的原因是____________________________。
(3)过滤Ⅱ后得到Zn(NH3)4CO3溶液,经直接蒸汽加热可析出碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O]沉淀,其反应化学方程式为____________________________。
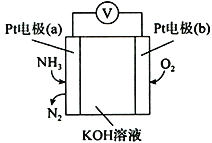
(4)蒸氨过程中会有部分氨气逸出,可用电化学气敏传感器监测环境中NH3的含量,原理如图所示。负极的电极反应为________________________________,假设蒸氨过程中逸出氨气16.8L (标准状况)进入传感器,另一极需要通入标准状况下O2的体积为____________________。
(5)蒸氨完成时,废液中残余氨含量需小于0.2mol/L,如果残余氨浓度过低,蒸汽用量增大,回收氨水中氨浓度降低,不利于循环使用;如果残余氨浓度过高,会导致____________________________。
【答案】 CaCO3 Zn 有副反应发生(或置换反应在固体表面进行,利用率不高) 3Zn(NH3)4CO3+3H2O![]() ZnCO3·2Zn(OH)2·H2O↓+12NH3↑+2CO2↑ 2NH3-6e-+6OH-=N2+6H2O 12.6L 残余锌浓度大,造成损失
ZnCO3·2Zn(OH)2·H2O↓+12NH3↑+2CO2↑ 2NH3-6e-+6OH-=N2+6H2O 12.6L 残余锌浓度大,造成损失
【解析】(1)菱锌矿粉、碳酸氢铵和熟石灰混合浸取后得到Zn(NH3)4CO3溶液和CaCO3沉淀等,通过过滤得到滤渣Ⅰ主要成分的化学式为CaCO3;(2)浸取液中含少量Pb2+、Cu2+等重金属离子,可加入试剂Ⅰ置换除去,故试剂Ⅰ为Zn;在实际操作过程中实际加入量远高于理论量,可能的原因是有副反应发生(或置换反应在固体表面进行,利用率不高);(3)过滤Ⅱ后得到Zn(NH3)4CO3溶液,经直接蒸汽加热可析出碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O]沉淀,其反应化学方程式为3Zn(NH3)4CO3+3H2O![]() ZnCO3·2Zn(OH)2·H2O↓+12NH3↑+2CO2↑;(4)根据图中信息,a电极上氨气中氮元素得电子生成氮气,作为负极,负极反应式为:2NH3-6e-+6OH-=N2+6H2O;b电极为正极,氧气得电子被还原,电极总反应式为:4NH3+3O2=2N2+6H2O,根据反应可知,假设蒸氨过程中逸出氨气16.8L (标准状况)进入传感器,另一极需要通入标准状况下O2的体积为16.8L×
ZnCO3·2Zn(OH)2·H2O↓+12NH3↑+2CO2↑;(4)根据图中信息,a电极上氨气中氮元素得电子生成氮气,作为负极,负极反应式为:2NH3-6e-+6OH-=N2+6H2O;b电极为正极,氧气得电子被还原,电极总反应式为:4NH3+3O2=2N2+6H2O,根据反应可知,假设蒸氨过程中逸出氨气16.8L (标准状况)进入传感器,另一极需要通入标准状况下O2的体积为16.8L×![]() = 12.6L;(5)蒸氨完成时,废液中残余氨含量需小于0.2mol/L,如果残余氨浓度过低,蒸汽用量增大,回收氨水中氨浓度降低,不利于循环使用;如果残余氨浓度过高,会导致残余锌浓度大,造成损失。
= 12.6L;(5)蒸氨完成时,废液中残余氨含量需小于0.2mol/L,如果残余氨浓度过低,蒸汽用量增大,回收氨水中氨浓度降低,不利于循环使用;如果残余氨浓度过高,会导致残余锌浓度大,造成损失。


科目:高中化学 来源: 题型:
【题目】根据下表中的信息分析回答问题:
元素 | 元素或由元素组成的物质性质 |
A | 单质在自然界中硬度最大,燃烧产生的气体能使澄清石灰水变浑浊。 |
B | 原子最外层电子数是次外层电子数三倍 |
C | 金属焰色反应为黄色,与氧气燃烧生成淡黄色固体 |
D | 单质在空气中体积分数最大 |
E | 固体为淡黄色,燃烧产生气体有漂白性。 |
F | 相同条件下气体密度最小 |
(1)用电子式写出形成F2E的过程__________________;
(2)写出CBF物质的电子式______________;
(3)C2B2物质中存在化学键的类型是___________ ,1 molC2B2与足量AB2反应转移的电子数为_______;
(4)由B、C、E形成的简单离子半径由大到小的关系是______________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠、氢氧化钠、碳酸钠和碳酸氢钠是生活中常见的物质.请回答下列问题.
(1)等质量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者后者(填>、<或=).
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为 .
(3)除去NaHCO3溶液中的少量Na2CO3 , 方法是: , 离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值,下列有关说法正确的是( )
A.78g过氧化钠晶体中,含2NA个阴离子
B.常温常压下,22.4L氦气含有NA个氦原子
C.在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA
D.常温下16g O2与O3的混合气体中含氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | |
① | Cu | CuO | Cu(OH)2 |
② | CH3CH2OH | CH3CHO | CH2═CH2 |
③ | Na2CO3 | NaOH | NaHCO3 |
④ | CaCO3 | CaO | Ca(OH)2 |
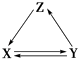
A.②③
B.③④
C.②④
D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中.按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中. 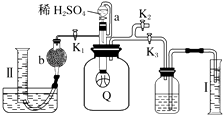
请回答下列问题:
(1)Q内发生反应生成种气体,其中的反应有个为氧化还原反应.
(2)为测定反应时生成气体的总体积,滴稀H2SO4前必须关闭(填“K1”、“K2”或“K3”),打开(填“K1”、“K2”或“K3”).
(3)当上述反应停止时,将K1、K2、K3均关闭,然后先打开K2 , 再缓缓打开K1 , 这时可观察到的现象是 .
(4)b中装的固体试剂是 , 需缓缓打开K1的原因为 .
(5)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y mL气体,则过氧化钠的纯度是(用含x、y的式子表示,上述体积均已折算成标准状况).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂离子电池电解质锂盐二氟草酸硼酸锂[LiBF2(C2O4)]的合成方法如下:2H2C2O4+SiCl4+2LiBF4→2LiBF2(C2O4)+SiF4+4HCl
(1)与氯同族的第四周期元素原子的基态核外电子排布式为_______________________。
(2)草酸分子(乙二酸,H2C2O4)中碳原子轨道的杂化类型是_____________,1mol草酸分子中含有σ键的数目为____________。
(3)与SiF4互为等电子体的阴离子的化学式为__________。BF4-的空间构型为_____________。
(4)第一电离能介于B、F两种元素之间的第二周期元素有__________种。
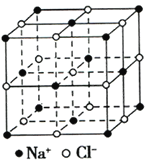
(5)已知NixO晶体晶胞结构为氯化钠型,由于晶体缺陷,x值小于1,一个Ni2+空缺,另有两个Ni2+被两个Ni3+取代,使化合物中Ni和O的比值发生了变化。某氧化镍样品组成为Ni0.93O,此晶体化学式为_______________________。(用含Ni2+、Ni3+表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.O2和O3互为同素异形体
B.乙醇(CH3CH2OH)和乙二醇(CH2OHCH2OH)互为同系物
C.氕、氘、氚互为同位素
D.甲烷的二氯代物结构只有一种的事实,可证明甲烷为正四面体结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com