
分析 (1)化学反应速率是利用单位时间内反应物浓度减小或生成物浓度增加表示,同意反应用不同物质表示反应速率可能不同,但表达意义相同且反应速率之比等于化学方程式计量数之比;
(2)SO2的起始浓度为2mol•L-1,2min后SO2的浓度为1.8mol•L-1,变化浓度=2mol•L-1-1.8mol•L-1=0.2mol•L-1,反应速率v=$\frac{△c}{△t}$,速率之比等于化学方程式计量数之比计算氧气表示的反应速率;
(3)压缩体积增大压强反应速率增大,浓度增大反应速率增大,催化剂加快反应速率不改变化学平衡,降低温度反应速率减小.
解答 解:(1)对于某一化学反应,用反应物和生成物浓度变化表示反应速率时,所得数值可能不同,但各物质速率比一定等于化学方程式计量数之比,
故答案为:可能不同;化学方程式计量数之比;
(2)SO2的起始浓度为2mol•L-1,2min后SO2的浓度为1.8mol•L-1,变化浓度=2mol•L-1-1.8mol•L-1=0.2mol•L-1,反应速率v(SO2)=$\frac{△c}{△t}$=$\frac{0.2mol/(L•min)}{2min}$=0.1mol/(L•min),速率之比等于化学方程式计量数之比计算氧气表示的反应速率,用O2的浓度变化表示的反应速率=$\frac{1}{2}$v(SO2)=0.05mol/(L•min),
故答案为:0.1mol/(L•min);mol/(L•min);
(3)对于反应2SO2(g)+O2(g)?2SO3(g),当其他条件不变时,压缩容器体积,压强增大则生成SO3的速率将增大,增大O2的浓度时,反应速率将增大,使用V2O5作催化剂时,反应速率将增大,降低温度时,反应速率将减小,.
故答案为:增大;增大;增大;减小.
点评 本题考查了化学反应速率计算、影响化学反应速率因素分析、化学反应中速率之比等于化学方程式计量数之比,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗1mol的H2O同时生成1mol的H2 | |
| B. | 两个H-O键断裂的同时有四个C-O键断裂 | |
| C. | 反应容器内的密度不再发生变化 | |
| D. | 混合气体的相对分子质量不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常通过电解熔融的MgO冶炼金属镁 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2 | |
| D. | 已知:①2H2(g)+O2(g)=2H2O(g)△H=-aKJ/mol ②2H2(g)+O2(g)═2H2O(l)△H=-bKJ/mol△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①和③ | C. | ①②③⑤ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、SO42-、NO3- | B. | Na+、K+、Br -、AlO2- | ||
| C. | Na+、NO3-、Cl-、SO42- | D. | Na+、K+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚中加入Na2CO3溶液中:CO32-+C6H5OH→C6H5O-+HCO3- | |
| B. | 0.3molFeI2与0.4molCl2在溶液中反应:6Fe2++10I-+8Cl2═6Fe3++16Cl-+5I2 | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应后溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
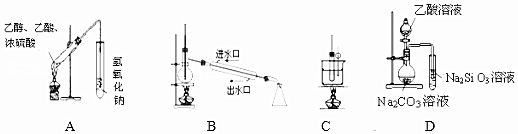
| A. | 装置用于制备乙酸乙酯 | |
| B. | 装置用于石油的分馏 | |
| C. | 装置用于实验室制硝基苯 | |
| D. | 装置可装置证明酸性:乙酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com