


科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
 2NH3(g)△H=-92kJ?mol-1
2NH3(g)△H=-92kJ?mol-1 2NH3(g)△H=-92kJ?mol-1
2NH3(g)△H=-92kJ?mol-1查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
| 5 |
| 2 |
| 5 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
查看答案和解析>>
科目:高中化学 来源: 题型:
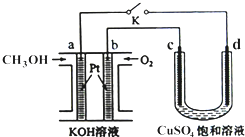 2012年 12 月7日,日本发生7.3级地震,大地震引起的核泄漏阴影再次引起了人们对核能源的恐慌.各国都在寻找替代核能的新型能源,而甲醇是未来重要的绿色能源之一.
2012年 12 月7日,日本发生7.3级地震,大地震引起的核泄漏阴影再次引起了人们对核能源的恐慌.各国都在寻找替代核能的新型能源,而甲醇是未来重要的绿色能源之一.查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ||||||||||||||||||
| ② | ③ | ④ | ||||||||||||||||
| ⑤ | ⑥ | |||||||||||||||||
| ⑦ | ||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com