
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
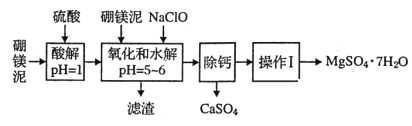
(1)实验中需用1mol/L的硫酸480mL,若用18.4mol/L的浓硫酸来配置,量取浓硫酸时需使用的量筒规格为(_______)。
A 10mL B 20mL C 50mL D 100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________________;滤渣中除含有氢氧化铁、氢氧化铝外还有_________。
(3)在“除钙”前需检验滤液中Fe3+是否被除尽,简述检验方法_____________________。
(4)已知硫酸镁、硫酸钙的溶解度如下表
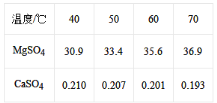
“除钙”是将;硫酸镁和硫酸钙混合溶液中的硫酸钙除去根据上表数据,采取的操作是_______________、趁热过滤、_________、____________,便得到比较纯净的硫酸镁。
(5)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O为172.2g,则MgSO4·7H2O的产率为__________________。
【答案】C 2Fe2++ClO-+2H+=2Fe3+-+Cl-+H2O SiO2 MnO2 取少许滤液于试管中,加入硫氰化钾溶液,若溶液不变红,说明Fe3+已除尽 蒸发浓缩 洗涤 干燥 70﹪
【解析】
由流程图可知,加入硫酸溶液调节溶液pH为1,MgO、CaO、MnO、Fe2O3、FeO、Al2O3金属氧化物都反应溶解,二氧化硅不反应溶解,再加入次氯酸钠溶液,溶液中Mn2+转化为MnO2沉淀,Fe2+被氧化为Fe3+,调节溶液pH为5—6,溶液中Fe3+和Al3+转化为氢氧化铁、氢氧化铝沉淀,过滤,滤渣中含有二氧化锰、二氧化硅、氢氧化铁和氢氧化铝,滤液中含有钙离子和镁离子,由图可知CaSO4的溶解度随温度的变化不大,而MgSO4在温度较高时溶解度大,蒸发浓缩、趁热过滤利于分离硫酸钙和硫酸镁,MgSO4溶液经蒸发、浓缩、结晶、过滤、干燥可得到晶体。
(1)实验中需用1mol/L的硫酸480mL应用500ml容量瓶配制,由稀释定律可得:1mol/L×0.5L=18.4mol/L×VL,V=0.027L=27ml,量取27ml浓硫酸时需使用的量筒规格为50ml,故答案为:C;
(2)溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应,反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;过滤,滤渣中含有二氧化锰、二氧化硅、氢氧化铁和氢氧化铝,滤液中含有钙离子和镁离子,故答案为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;SiO2、MnO2;
(3)检验滤液中Fe3+是否被除尽的操作是取少许滤液于试管中,加入硫氰化钾溶液,若溶液不变红,说明Fe3+已除尽,故答案为:取少许滤液于试管中,加入硫氰化钾溶液,若溶液不变红,说明Fe3+已除尽;
(4)由图可知CaSO4的溶解度随温度的变化不大,而MgSO4在温度较高时溶解度大,蒸发浓缩、趁热过滤利于分离硫酸钙和硫酸镁,MgSO4溶液经蒸发、浓缩、结晶、过滤、干燥可得到晶体,故答案为:蒸发浓缩;洗涤;干燥;
(5)100g硼镁泥中含有氧化镁的质量为100g×40%=40g,氧化镁的物质的量为1mol,则生成MgSO4·7H2O的质量为1mol×246g/mol=246g,则MgSO4·7H2O的产率为172.2g/246g×100%=70%,故答案为:70%。


科目:高中化学 来源: 题型:
【题目】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液,加氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入5mL0.2mol·L-1盐酸,产生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.287g。
下列说法中正确的是( )
A.该溶液中一定不含Ba2+、Mg2+、Al3+、SiO32-、Cl-
B.该溶液中一定含有K+、AlO2-、CO32-、Cl-
C.该溶液是否有K+需做焰色反应实验(透过蓝色钴玻璃片)
D.可能含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50ml浓H2SO4溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________生成SO2的体积为(标准状况下)____________mL.
(2)若题干中浓硫酸的物质的量浓度为amol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)____0.025amol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,则原浓硫酸的物质的量浓度为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素是短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W是该元素所在周期原子半径最大的元素,W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键,该分子中含有10个电子。Z原子最外层电子数是次外层电子数的3倍,试判断:
(1)Y和W两种元素的元素符号为Y________,W________。
(2)W2Z2的电子式为________________。
(3)①由X、Y、Z所形成的常见离子化合物是__________________(写化学式)。
②该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为___________。
③化合物WY3的晶体结构中含有的化学键为________(选填序号)。
A.只含离子键 B.只含共价键 C.既含离子键又含共价键
④X与W形成的化合物与水反应时,水作________(填“氧化剂”或“还原剂”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体 X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应: X(g) + Y(g) 2Z(g) △ H < 0.一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是( )

A.反应前 2 min 的平均速率v(Z) > 2.0 × 103 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前:v(逆) > v(正)
C.保持其他条件不变,起始时向容器中充入0.32 mol气体 X和0.32 mol气体Y,到达平衡时,c(Z) > 0.24 mol·L-1
D.该温度下此反应的平衡常数:K = 1.44
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示![]() 图中有些反应的生成物和反应的条件没有标出
图中有些反应的生成物和反应的条件没有标出![]() 。
。
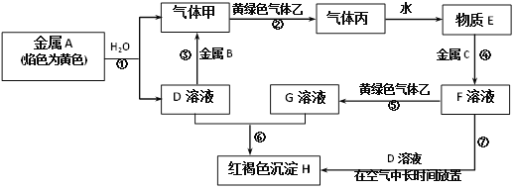
请根据以上信息完成下列各题:
(1)写出下列物质的化学式:B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.分子式为C15H16O2的部分同分异构体中可能含有联苯结构单元
B.1.0 mol的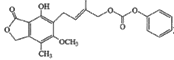 最多能与含4.0 mol NaOH的水溶液完全反应
最多能与含4.0 mol NaOH的水溶液完全反应
C.乳酸薄荷醇醋(![]() )能发生水解、氧化、消去反应
)能发生水解、氧化、消去反应
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,核磁共振氢谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用核磁共振氢来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以锈蚀程度很大的废铁屑为原料制备FeCl3·6H2O晶体的流程可简要表示如下:
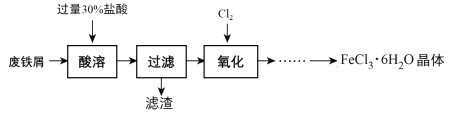
已知:在水溶液中Fe2+能与K3Fe(CN)6生成蓝色沉淀Fe3[Fe(CN)6]2。
试回答下列问题:
(1) “酸溶”过程中发生主要反应有:
①Fe + 2H+= Fe2++ H2↑;②Fe2O3+ 6 H+= 2Fe3++ 3H2O;③__________________。(用离子方程式)
(2) “酸溶”需控制温度在40℃左右,最佳的加热方式是____________。
(3) “氧化”过程可在下图所示装置中进行。
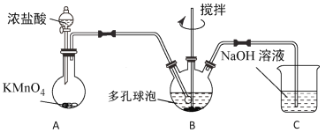
①装置A中KMnO4与浓盐酸反应生成MnCl2和Cl2,其离子方程式为______________________。
②装置C的作用是__________________________________________________。
③为使Cl2能充分发生反应,除在B中使用多孔球泡和搅拌外,实验中可采取的措施是_____________________________________________________________________。
④证明装置B溶液中Fe2+已完全________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中加热S粉和Fe粉的混合物,可观察到下列现象:
(1)有淡蓝色火焰,且生成刺激性气味的气体。
(2)混合粉末变红,放出热量,最后变成黑色固体。
(3)不时有火星从混合物中射出。
请分别写出以上三种情况发生反应的化学方程式:__________、__________、__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com