
| A、标准状况下,11.2L SO3中所含有的原子数2NA |
| B、实验室中用4mol HCl的浓盐酸跟足量MnO2 加热反应可制得的Cl2分子数为NA |
| C、25℃时,pH=13的1.0L Ba(OH)2溶液中含有OH-的数目为0.2NA |
| D、2.3g钠与一定量的氧气完全反应,转移的电子数一定为0.1NA |
| N |
| NA |
| m |
| M |
| N |
| NA |
| 10-14 |
| 10-13 |
| m |
| M |
| 2.3g |
| 23g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、W、X、Y、Z原子的核外最外层电子数的总和为20 |
| B、上述W、X、Y元素的原子半径大小为W<X<Y |
| C、由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
| D、W与Y可形成既含极性共价键又含非极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下:
现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下:| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的液体 | ||
| 1 | 25.00 | 0.50 | 26.80 | 26.30 |
| 2 | 25.00 | |||
| 3 | 25.00 | 5.00 | 31.34 | 26.34 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2的水溶液中:c(H+)>c(HSO3-)=2c(SO32-) |
| B、室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| C、室温下,pH=1的NaHSO4溶液:c(SO42-)+c(OH-)=0.1mol |
| D、含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4+)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2(g)+
| ||
| B、H2(g)+O2(g)=2H2O(1)△H=-235kJ.mol-1 | ||
C、H2(g)+
| ||
| D、H2(g)+O2(g)=H2O(1)△H=-470kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
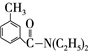 DEET在一定条件下,可通过下面的路线来合成:
DEET在一定条件下,可通过下面的路线来合成:
| SOCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com