
| A、能够使甲基橙呈现黄色 |
| B、溶液的pH>7 |
| C、溶液中:c(H+)<c(OH-) |
| D、溶液中:c(H+)>1×10-7mol?L-1 |


科目:高中化学 来源: 题型:
| A、1L 0.3mol/L CH3COOH溶液和3L 0.1mol/L CH3COOH溶液中的H+数 |
| B、pH=1的CH3COOH溶液和盐酸的物质的量浓度 |
| C、pH=12的氨水和NaOH溶液的导电能力 |
| D、等pH值的碳酸钠溶液和醋酸钠溶液的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K(HF)=7.2×10-4 |
| B、K(HCN)<K(HNO2)<K(HF) |
| C、根据①③两个反应即可知三种酸的相对强弱,相同条件下HCN的酸性最弱 |
| D、相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用食醋除去暖瓶内的水垢 |
| B、用75%的乙醇溶液进行皮肤消毒 |
| C、碘单质遇淀粉变蓝 |
| D、鸡蛋白溶液中加入硫酸铵饱和溶液后析出白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CO2的电子式是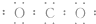 |
| B、乙烯的结构简式是C2H4 |
C、Cl-的结构示意图 |
| D、K 原子的价层电子排布是1s22s22p63s23p64s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇(乙酸):生石灰,过滤 |
| B、苯(苯酚):溴水,过滤 |
| C、乙酸乙酯(乙酸):氢氧化钠溶液,分液 |
| D、乙烷(乙烯):溴水,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com