
| A. | 在豆浆里加入盐卤做豆腐 | |
| B. | 在河流入海处易形成沙洲 | |
| C. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 | |
| D. | 用一支钢笔使用不同品牌墨水时,容易发生堵塞 |
分析 可根据胶体的性质来分析解答,向胶体中加入电解质可以使胶体凝聚,胶体能产生丁达尔效应.
解答 解:A.豆浆具有胶体的性质,向其中加入盐卤,盐卤中含丰富的电解质氯化镁等,可以使豆浆凝聚,与胶体有关,故A错误;
B.河流中的水含有泥沙胶粒,海水中含有氯化钠、氯化钙等电解质,二者相遇是可以发生胶体凝聚,就形成三角洲,与胶体有关,故B错误;
C.主要发生了复分解反应,与胶体性质无关,故C正确;
D.墨水是胶体,不同的墨水可能是不同的胶体,有的胶体胶粒(胶体本身不带电,胶粒带电荷)带正电、有的胶体胶粒带负电,带不同电荷的胶粒的胶体容易聚沉形成沉淀,所以,能把钢笔堵住是胶体的性质,故D错误.
故选C.
点评 本题考查胶体的性质,难度不大,明确胶体常见的性质有丁达尔现象、胶体的聚沉、电泳等,利用胶体性质对生产生活中实际问题进行解释.


科目:高中化学 来源: 题型:选择题
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2═Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n(HNO3(稀))═1:3 4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将两种带相反电荷的胶体混合,能发生聚沉 | |
| B. | 有化学键断裂的变化一定是化学变化 | |
| C. | IA族元素形成的单质的熔点随原子序数的递增而降低 | |
| D. | 碱性氧化物一定是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “另一种反应物”一定只具有氧化性 | B. | “另一种反应物”一定具有还原性 | ||
| C. | 点燃时:2CuH+3Cl2═2CuCl2+2HCl | D. | CuH 既可做氧化剂也可做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
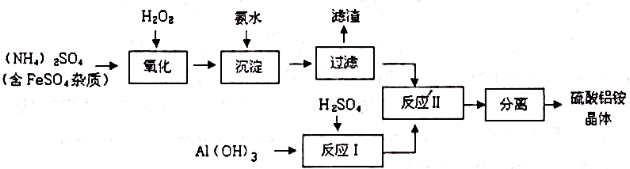

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com